مقدمة
تأسست المنظمة الدولية للمعايير (ISO) عام 1947 بوصفها منظمة غير حكومية تابعة للأمم المتحدة بهدف تنشيط الاقتصاد العالمي بعد الحرب العالمية الثانية. ركزت المنظمة الدولية للمعايير (ISO) في المقام الأول على توحيد معايير المنتجات الصناعية وعمليات التصنيع لتسهيل التجارة الدولية. تتم المشاركة وحقوق التصويت على أساس كل دولة على حدة، ولكن التنفيذ عالمي، وتختلف الطريقة التي تجمع بها كل دولة الآراء.
تتم صياغة معايير المنظمة الدولية للمعايير (ISO) في المقام الأول من قِبل الشركات المصنِّعة، ولكن تنوع المدخلات من قِبل المتخصصين في الرعاية الصحية أمر ضروري في قطاعات مثل الأجهزة الطبية. غالبًا ما تقود الشركات المصنِّعة تطوير المعايير نظرًا إلى خبرتها في عمليات التصنيع والامتثال التنظيمي. ولكن، في غياب مدخلات كافية من الخبراء السريريين، يكون هناك خطر عدم معالجة المعايير بشكل كامل للاحتياجات السريرية ومخاوف السلامة لدى العاملين في القطاع الطبي.
على عكس المعدات الصناعية العامة، فإن العديد من الأجهزة الطبية السريرية تولي اهتمامًا أكبر لكيفية استخدامها بدلاً من مواصفاتها الفنية. ومن المهم أن ندرك أن المسؤولية النهائية عن استخدام الأجهزة الطبية تقع على عاتق الطبيب، الذي يتعين عليه أن يتحمل المسؤولية الكاملة عن حياة مرضاه.
ورغم الجهود المبذولة لدمج آراء الخبراء الطبيين من خلال اللجان الفنية، فإن مشاركة الأطباء لا تزال محدودة في بعض المجالات، إذ غالبًا ما تكون الشركات المصنِّعة هي من تقود المناقشات.
معيار ISO 80369
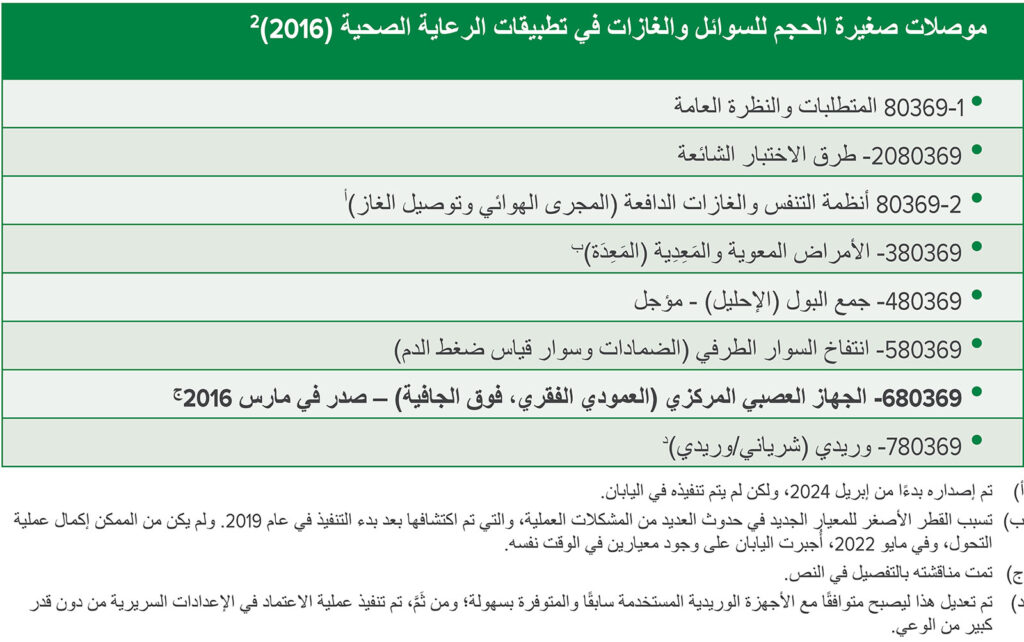
لقد دفع الوعي الدولي المتزايد بالسلامة الطبية المنظمة الدولية للمعايير (ISO) إلى معالجة الحوادث الطبية الناجمة عن الأخطاء المتعلقة بالتوصيل وإعطاء الدواء من خلال تطوير معايير تصميم موصلات فريدة لأنظمة رعاية المرضى المتعلقة بالأمعاء والجهاز التنفسي والجهاز البولي وضغط الدم والجهاز العصبي المركزي والأوردة.1، 2 وبدأت المنظمة الدولية للمعايير (ISO) في إصدار سلسلة معايير ISO 80369 في عام 2016.2 وتم تشجيع البلدان المشاركة على اعتماد هذه المعايير الدولية من دون تأخير (الجدول 1، الشكل 1).
الجدول 1: معيار ISO 80369:
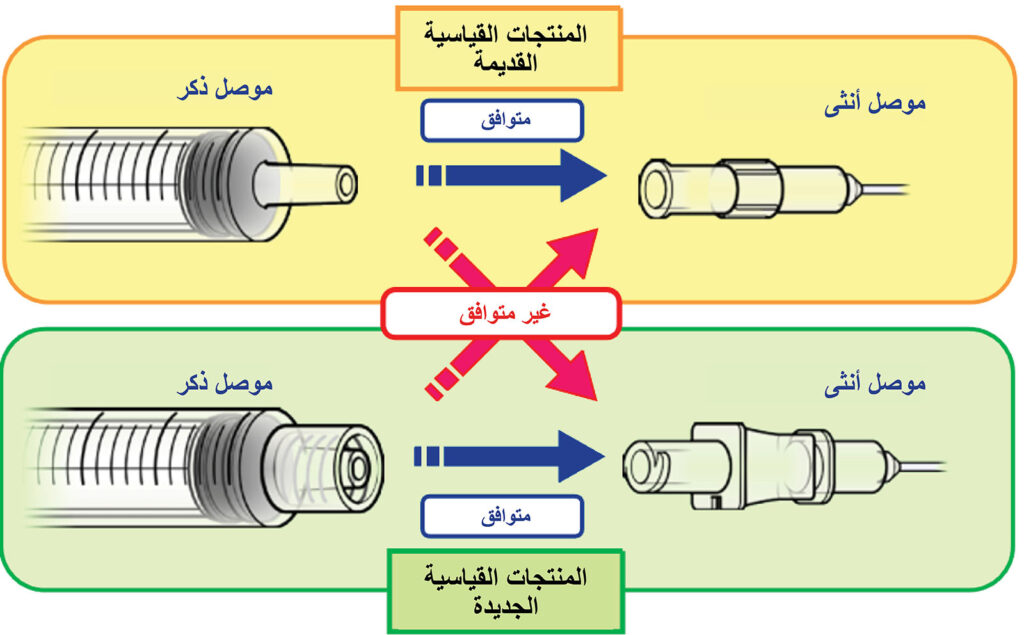
الشكل 1: موصل (Luer) المطابق للمعيار القديم والموصل المطابق للمعيار الجديد (معيار ISO 80369-6).
معلومات السلامة الطبية الصادرة عن وكالة الأدوية والأجهزة الطبية (PMDA)، رقم 55 لشهر أغسطس 2018، الموصلات المطابقة للمعايير الجديدة والقديمة للمنتجات على الموقع الإلكتروني http://www.pmda.go.jp/english/safety/info-services/safety-information/0001.html
لقد طبقت اليابان معيار ISO 80369-6 (التطبيقات المتعلقة بالجهاز العصبي المركزي) على مستوى البلاد تحت قيادة حكومية بعد تلقي معلومات (المصدر غير معروف) تفيد بأن تطبيق معيار ISO 80369-6 قد بدأ على مستوى العالم، بما في ذلك أجزاء من الولايات المتحدة. والآن اكتمل التحول تقريبًا، وفي حين لم يتم الإبلاغ عن أي حوادث كبرى تنطوي على فقدان الأرواح أثناء عملية التحول، فقد حدث العديد من المشكلات الخطيرة. وبقدر ما نعلم، لم تتحول أي دولة أخرى بالكامل إلى هذا المعيار الجديد، ومن ثَمَّ فإن تجربة اليابان يمكن أن تساهم في سلامة المرضى في جميع أنحاء العالم من خلال زيادة الوعي بالمشكلات المرتبطة التي يمكن أن تحدث.
الحاجة إلى معيار جديد للتطبيقات المتعلقة بالجهاز العصبي المركزي (معيار ISO 80369-6)
 على مدى سنوات عديدة في الممارسة السريرية، كان موصل Luer (ISO-594) هو المعيار للحقن وتوصيل الأنابيب ذات القطر الصغير. وقد استفاد مقدمو الرعاية الصحية من السهولة التي يوفرها التوصيل الشامل. ومع ذلك، فإن منع الحقن العرضي بسبب سوء توصيل موصلات Luer يعتمد فقط على يقظة ومسؤولية العاملين الطبيين المعنيين.
على مدى سنوات عديدة في الممارسة السريرية، كان موصل Luer (ISO-594) هو المعيار للحقن وتوصيل الأنابيب ذات القطر الصغير. وقد استفاد مقدمو الرعاية الصحية من السهولة التي يوفرها التوصيل الشامل. ومع ذلك، فإن منع الحقن العرضي بسبب سوء توصيل موصلات Luer يعتمد فقط على يقظة ومسؤولية العاملين الطبيين المعنيين.
ولقد أدى الخطأ البشري، وهو سبب لا مفر منه لإصابة المريض، إلى حدوث خطأ في توصيل العديد من أنواع الأجهزة الطبية.1 وقد بدأت المناقشات حول سلسلة معايير ISO 80369 تقريبًا عام 2005 بهدف تطوير توصيلات محددة الغرض تستخدم آليات مادية من دون ربط مخصصة لكل تطبيق من أجل ضمان عدم إمكانية حدوث خطأ في التوصيل ببساطة.
تم إجراء مناقشات حول معيار توافقي محدد الغرض لمنع الأخطاء المتعلقة بالتوصيل (سلسلة معايير ISO 80369) من قِبل المنظمة الدولية للمعايير (ISO) في اللجنة الفنية 210 (TC 210، إدارة الجودة)، بالتنسيق مع اللجنة الفنية 121 (TC 121) عبر مجموعة العمل المشتركة 4. تغطي اللجنة الفنية 210 (TC 210) مجموعة أوسع من الموضوعات وليست بالضرورة لجنة فنية (TC) تركز على التخدير، خصوصًا بالمقارنة مع اللجنة الفنية 121 (TC 121) حيث يشارك العديد من اختصاصيي التخدير البارزين. تم تشكيل مجموعة عمل مشتركة تحت إشراف اللجنة الفنية 210 (TC 210) لنقل آراء اللجنة الفنية 121 (TC 121) بشأن هذه المسألة، ولكن للأسف كانت غير فعالة.
شارك اختصاصيو التخدير بشكل فعال منذ المراحل المبكرة، حيث قدموا إسهامات كبيرة في مجال التخدير والعناية المركزة. تضم اللجنة الفنية 121 (TC 121) اللجنة الفرعية 3 (SC-3) التي تتعامل مع المنتجات التي يتعامل معها اختصاصيو التخدير بشكل مباشر، مثل أجهزة التنفس الصناعي، وأجهزة تركيز الأكسجين، وأجهزة مراقبة المرضى ذات الصلة.
عملية اتخاذ القرار لتنفيذ معيار ISO 80369-6 في اليابان
في اليابان، لا يزال نظام التنفيذ كما كان عليه عندما تأسست المنظمة الدولية للمعايير (ISO) لأول مرة. والهيئة الإشرافية الرئيسية للأجهزة الطبية التي تؤثر في حياة الإنسان هي وزارة الصحة والعمل والرفاهية (MHLW)، التي تمتلك أيضًا سلطة الترخيص. ومع ذلك، فإن وزارة الاقتصاد والتجارة والصناعة (METI)، التي تشرف على الصناعات العامة، تتواصل مع المنظمة الدولية للمعايير (ISO). وفي الممارسة العملية، تتدفق المعلومات من وزارة الاقتصاد والتجارة والصناعة (METI) إلى وزارة الصحة والعمل والرفاهية (MHLW). ونتيجة لذلك، هناك نقص في الإشراف ونقص في المشاركة الاستباقية من جانب الأطباء على المستوى المحلي والدولي.
عندما تمت مناقشة تنفيذ معيار ISO 80369 لأول مرة في قسم السلامة بوزارة الصحة والعمل والرفاهية (MHLW) في عام 2015 مع بعض ممثلي الرعاية الصحية، كان التحول إلى معيار ISO 80369-6 متوقعًا بالفعل. وقد أثار اختصاصيو التخدير مخاوف في ذلك الوقت بشأن الارتباك المحتمل الناجم عن التحول، ولكن في الممارسة العملية، لم تكن هناك اجتماعات تضم الأطباء السريريين أو الجمعية اليابانية لأطباء التخدير (JSA). تم تحديد الإجراءات والمواعيد النهائية للتقديم بين وزارة الصحة والعمل والرفاهية (MHLW) ومؤسسة صناعية هي جمعية التكنولوجيا الطبية اليابانية (MTJAPAN). وأوضحت الوزارة أن اليابان، بصفتها عضوًا في منظمة التجارة العالمية، لديها التزام أساسي بالامتثال لمعايير المنظمة الدولية للمعايير (ISO) أو التوافق معها.3 ورغم وجود استثناءات، فإن اليابان ملزمة باعتماد معيار المنظمة الدولية للمعايير (ISO) كمعيار وطني من دون تأخير بعد إصدار معيار جديد، ولا يُسمح بالتغييرات التي من شأنها أن تخلق حواجز تجارية دولية.
في حين أنه من الضروري دراسة التوازن بين المخاطر والفوائد بعناية في الإعدادات السريرية قبل تنفيذ معايير المنظمة الدولية للمعايير (ISO)، إلا أنه لا توجد منظمات أو فرص للمناقشة بشأن هذه الاعتبارات في اليابان.
أصدرت وزارة الصحة والعمل والرفاهية (MHLW) إخطارًا في 29 ديسمبر 2017، ينص على أن بيع المنتجات القديمة المتأثرة بمعيار ISO 80369-6 يجب أن يتوقف بحلول نهاية فبراير 2020. تم تحديد الموعد النهائي لتوريد المنتجات بما يتناسب مع رغبة الشركة، ومن ثَمَّ لم يكن أمام اختصاصيي التخدير خيار غير الامتثال.
بناءً على الطلب القوي من اختصاصيي التخدير العاملين بالمؤسسات الطبية، لم يتم إدخال محوِّل قابل للتبديل لأسباب تتعلق بالسلامة. وقد أجرت جمعية الصناعة للشركات المصنِّعة والموردين أنشطة توعية، مستهدفة الجمعيات الأكاديمية ذات الصلة. قدمت وكالة الأدوية والأجهزة الطبية (PMDA) تفاصيل محددة حول إجراءات التنفيذ. ورغم هذه التدابير، لم يكن الوعي بالحاجة إلى التحول وإمكانية ذلك معروفًا جيدًا لاختصاصي التخدير.
استطلاع رأي أجرته وزارة الصحة والعمل والرفاهية (MHLW) حول التحول إلى معيار ISO 80369-6 في اليابان
لقد تم تنفيذ عملية التحول واكمالها خلال عامين تقريبًا. في يونيو 2024، أصدرت وزارة الصحة والعمل والرفاهية (MHLW) تقريرًا عن التحول إلى معيار ISO 80369-6، والذي بدأ في عام 2021.4 يتضمن التقرير نتائج استطلاع رأي بريدي محدود النطاق، لاختصاصيي التخدير وجمعية التكنولوجيا الطبية اليابانية (MTJAPAN). كان استطلاع الرأي يستهدف بشكل أساسي المنشآت المعتمدة من قبل الجمعية اليابانية لأطباء التخدير (JSA)، حيث تم الاتصال بعدد 1447 منشأة، و329تم تلقي 329 ردًا صالحًا.
لم يكن الهدف من استطلاع الرأي الذي أجرته وزارة الصحة والعمل والرفاهية (MHLW) هو التأكد من الحالات الطارئة المتعلقة بالمرضى، بل التحقيق في القضايا المتعلقة بالمنتج؛ ومن ثَمَّ، كان هناك احتمال لعدم الإبلاغ عن الأحداث غير المرغوب فيها التي يتعامل معها اختصاصيو التخدير.
النتائج والمشكلات التي حددها استطلاع الرأي الذي أجرته وزارة الصحة والعمل والرفاهية (MHLW)
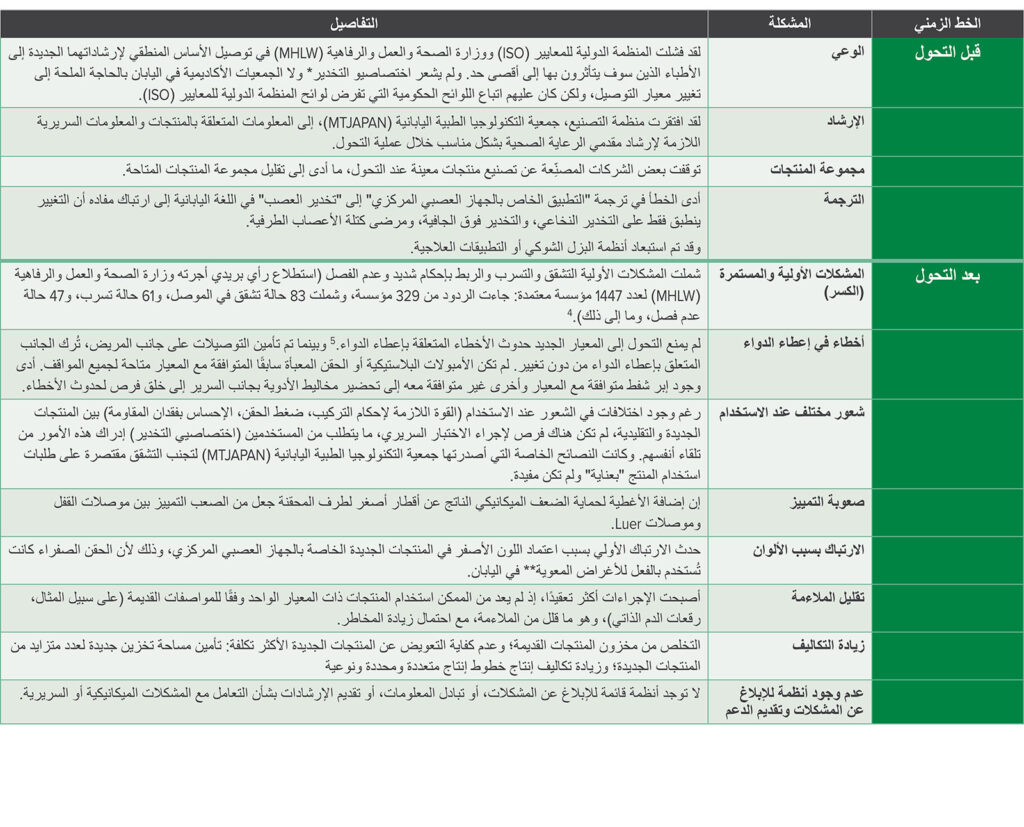
تم تلخيص النتائج الرئيسية لاستطلاع الرأي في الجدول 2. ولقد أصابتنا الصدمة من عدد المشكلات الأولية التي واجهناها.
الجدول 2: المشكلات التي تمت مواجهتها مع التغيير إلى معيار ISO 80369-6.
لقد أدى عدم كفاية الإرشادات المتوفرة قَبل التحول إلى وضع الأطباء في موقف غير مؤاتٍ، حيث لم يكونوا مستعدين للتغييرات. وقد تم الإبلاغ عن عديد من حالات الكسر والتسرب أثناء رعاية المرضى. ولم يتضرر أي مريض بسبب التفكير السريع من جانب اختصاصيي التخدير.
كانت الأخطاء المتعلقة بإعطاء الدواء مصدر قلق دائمًا، حيث لم تكن مجموعات الموصلات التي تحتوي على الموصلات والحقن المعبأة سابقًا متوفرة بالكامل.5 ولم يتم تجنب الأخطاء الناجمة عن التوصيل غير الصحيح للأدوية إلا بفضل توخي الحرص المهني.6
لقد أدى عدم اكتمال عمليات التحول بسبب عدم توفر جميع الحقن والموصلات إلى حدوث ارتباك في التعامل مع المرضى، حيث تم وضع الموصلات القديمة والجديدة معًا. كما نتج عن ذلك ارتباك غير ضروري آخر نتيجة للترجمة الرديئة، والتداخل في ألوان الموصلات، وعدم توفر المنتج بشكل كافٍ، وإهدار الموارد. وفوق كل ذلك، لم تكن هناك إجراءات متاحة للأطباء، قبل عملية التحول أو بعدها، لنقل المشكلات أو الإبلاغ عنها.
وقد أثيرت عدة قضايا على النحو التالي:
1. عدم كفاية المشاركة السريرية
عانت كل من عملية صياغة معيار ISO 80369-6 وعملية التنفيذ المحلية اليابانية من قِبل الحكومة والشركات المصنِّعة من نقص المعلومات السريرية العملية.
بمجرد وضع معايير ISO 80369، لم يكن هناك نقاش يذكر حول ما إذا كان ينبغي للوكالات الحكومية في اليابان تجهيز الوضع السريري المحلي أو تعديله.
2. وجهات نظر غير متوازنة (الأطباء، والشركات المصنِّعة، والهيئات التنظيمية)
لقد افترضت الشركات المصنِّعة أنه من المقبول، بل ومن غير الممكن تجنبه، إنتاج وصلات، متوافقة مع المعايير، لكنها صعبة الاستخدام، وخصوصًا من قِبل المستخدمين غير المطلعين. ولو كان الأطباء على علم بهذا، لكانوا قد رفضوا استخدام المنتجات لأن سلامة المرضى معرضة للخطر.
أدى التحول إلى أقطار أصغر من دون إجراء تجارب سريرية إلى ارتباك في الاستخدام في ما يتعلق بالتغيرات في تدفق السائل وزيادة قوى الدفع والتدوير. وتضمنت المشكلات صعوبة الاستخدام وكسر الموصلات. ولقد أجبر هذا الأطباء على التعامل مع مشكلات مثل الوصلات الصلبة للغاية وتسرب السوائل من الموصلات المتشققة أثناء العمل الفعلي.
3. عدم وجود تجارب جدوى سريرية
كان من الضروري للغاية إجراء دراسات الجدوى السريرية على المنتجات (تكون بين منتجات شركات مختلفة) قبل التنفيذ المحلي لتجنب إلحاق الضرر بالمريض وإلقاء المسؤولية على الطبيب. ومع ذلك، تم رفض التجارب السريرية قبل التطبيق الكامل على أساس تصور خاطئ ومتحيز لدى الهيئات التنظيمية والشركات المصنِّعة التي تقول إن هذا من شأنه أن ينتهك قوانين المنافسة. كان من الممكن تجنب معظم المشكلات التي واجهتها اليابان أثناء التنفيذ بالمعلومات والإعداد المناسبين. ومن المؤسف أن الأطباء تم إقصاؤهم فعليًا من هذه المناقشة، ولم يعد أمامهم خيار سوى قبول القرار الإداري.
4. عدم الشفافية
كانت الهيئات التنظيمية لديها اعتقاد خاطئ أن تجارب الجدوى السريرية غير ضرورية لأن المنتجات الجديدة التي تم طرحها تتوافق بالفعل مع معيار ISO الجديد المعتمد. ولم ترَ الشركات المصنِّعة ضرورة لإبلاغ الأطباء بالتغييرات “الصغيرة” في كيفية ملاءمة المنتجات الجديدة مع بعضها. ولم يكن الأطباء على دراية بهذا الوضع في اليابان ولم يكن لديهم مكان لمعالجة هذه المخاوف.
إن عملية بناء الإجماع في المنظمة الدولية للمعايير (ISO) ليست متاحة لمن هم خارج المجموعة، ولكن الامتثال للمعايير المُنتجة إلزامي ويتم الترويج له بقوة من قِبل الهيئات الإدارية المحلية في اليابان. حاليًا، لا يستطيع المستخدمون (الأطباء)، الذين يتعين عليهم اتباع المعايير، التعرف على المعايير إلا بعد شراء المنشورات الرسمية للمنظمة الدولية للمعايير (ISO).
إن هذه العملية تحتاج إلى تحسين لأنها لا تعوق نشر المعلومات في الوقت المناسب فحسب، بل إنها أيضًا تقنية للغاية بحيث يصعب على العاملين في مجال الرعاية الصحية العاديين فهمها. وبسبب عدم إدراكهم أن المعايير الجديدة أدت إلى إنتاج منتجات تختلف بشكل كبير عن ذي قبل، واجه الأطباء تبعات سريرية وخيمة مثل تسرب السوائل وتشقق الموصلات بسبب الوصلات الصلبة للغاية. وكان عليهم التعامل مع مثل هذه المشكلات أثناء خضوع المرضى للجراحة.
دور الأطباء في تنفيذ معايير المنظمة الدولية للمعايير (ISO) محليًا
تنشأ تحديات محليًا في ما يتعلق بضمان تلبية المعايير متطلبات الرعاية الصحية المحلية، وقابلية الاستخدام، وسلامة المرضى. وتشمل هذه التحديات مراعاة مدى توفر المنتج، والتغييرات في الوظائف مقارنة بالمعايير السابقة، ومستوى التعليم، ونطاق المسؤولية المهنية.
إن دراسات الجدوى التي يجريها الأطباء قبل تطبيق المعايير تشكل أهمية بالغة لحماية المرضى والتحقق من فعالية المعايير في سياقات وطنية محددة، ولكن هذه الدراسات رُفِضت بحجة قانون المنافسة. ويتطلب التكامل الفعال لمعايير المنظمة الدولية للمعايير (ISO) تحقيق التوازن بين كفاءة الشركات المصنِّعة والمشاركة الشاملة للأطباء وعمليات الاعتماد المحلية المستجيبة. ومن وجهة نظر الأطباء، كان الافتقار إلى إجراء اختبارات قابلية الاستخدام السريرية قبل التنفيذ أمرًا مؤسفًا حقًا.
وتحدث مشكلة مماثلة مع معيار ISO 80369-3 (التطبيقات المتعلقة بالأمعاء). فقد واجه أطباء الأطفال مشكلات عملية، مثل عدم القدرة على إعطاء الأطعمة السائلة أو شفط محتويات المعدة بسبب القطر الأصغر بكثير للمعيار الجديد. ولقد تأخر التحول، الذي بدأ في عام 2019 وكان من المقرر أن يكتمل بحلول عام 2021. وكانت وزارة الصحة والعمل والرفاهية (MHLW) قد قدمت بالفعل معيارًا للموصل غير القابل للتبديل في عام 2000 (MHLW No. 888) الذي لاقى استحسانًا جيدًا، ولكنها اضطرت إلى التحول إلى معيار ISO 80369-3. واضطرت اليابان إلى السماح بالمعايير القديمة والجديدة في مايو 2022.7 ولا يزال الارتباك قائمًا حتى يومنا هذا.
ومن المدهش أن مثل هذا الخطأ الأساسي لم يُلاحظ أثناء وضع معيار المنظمة الدولية للمعايير (ISO). فقد قدمت اليابان معيارها الخاص للموصل المعوي غير القابل للتبديل في عام 2000، ومن المؤسف أن المعيار الياباني الذي أثبت كفاءته بالفعل لم يتم اعتماده من قِبل المنظمة الدولية للمعايير (ISO).
الملخص
أصدرت المنظمة الدولية للمعايير (ISO) سلسلة من معايير ISO 80369 لتقييد استخدام التوصيلات بين الحقن والإبر والمكونات الأخرى ذات القطر الصغير على أغراضها المقصودة فقط. بدأت السلطات الإدارية اليابانية مبادرة وطنية للتعريف بمعيار ISO 80369-6 (التطبيقات المتعلقة بالجهاز العصبي المركزي) في عام 2018 كجزء من تنفيذ المعايير الجديدة. وعلى حد علمنا، هذا هو أول تحول يتم على مستوى دولة في العالم.
ولقد اتُّخذ هذا القرار من دون تشاور كافٍ مع الأطباء أو المنظمات المهنية للتخدير. وكانت تتم الموافقة على المنتجات الجديدة في اليابان إذا كانت متوافقة مع المعايير الجديدة للمنظمة الدولية للمعايير (ISO)، ولكن كان يتم استخدامها في الممارسة السريرية من دون أي تجارب جدوى أولية. ولقد افتقر اختصاصيو التخدير بالمنشآت الطبية إلى المعلومات الكافية، وواجهوا كثيرًا من المشكلات غير المتوقعة، مثل الكسر والتسربات.
ولم يتم الإبلاغ عن أي حوادث كارثية تتعلق بأرواح بشرية أثناء عملية التحول، لكننا شهدنا حوادث خطيرة لا يمكن تجاهلها.
يتعين على الأطباء والجمعيات الطبية، مثل الجمعية اليابانية لأطباء التخدير (JSA) ومؤسسة APSF، أن يشاركوا بشكل أكبر في زيادة مستوى الوعي لدى المنظمة الدولية للمعايير (ISO) والقطاع الصناعي والهيئات التنظيمية المحلية بالأهمية الأساسية للمدخلات السريرية. إن أحد الأسباب التي تجعل الحكومة والصناعات تتمتع بصوت قوي للغاية في اليابان بسبب حالة التباعد الشديد بين التخصصات الطبية ما يجعل من الصعب على الجميع العمل معًا.
في البيئة السريرية، مراعاة كيفية استخدام المنتج إلى جانب جودة المنتج نفسه أمر مهم للغاية. والأمر الأكثر أهمية هو حماية حياة المرضى. ولا ينبغي لاختصاصيي التخدير أن يتسامحوا مع المواقف التي تهدد سلامة المرضى. وينبغي لنا أن نشارك بشكل أكبر في عملية اتخاذ القرار بشأن الأجهزة الخاصة بالفترة المحيطة بالجراحة المعتمدة من قِبل المنظمة الدولية للمعايير (ISO).
Sachiko Omi، MD، PhD، أستاذة زائرة في التخدير، جامعة طوكيو جيكاي الطبية، طوكيو، اليابان.
Akito Ohmura، MD، PhD، أستاذ فخري في كلية الطب بجامعة تيكيو، طوكيو، اليابان، ورئيس اللجنة الفرعية الثالثة (SC-3) باللجنة الفنية 121 (TC 121) في المنظمة الدولية للمعايير (ISO).
Katsuyuki Miyasaka، MD، PhD، أستاذ فخري في جامعة سانت لوك الدولية، طوكيو، اليابان.
ليس لدى المؤلفين أي تضارب في المصالح.
المراجع
- Examples of Medical Device Misconnections. https://www.fda.gov/medical-devices/medical-device-connectors/examples-medical-device-misconnections. Accessed July 30, 2024.
- ISO 80369-6:2016 Small bore connectors for liquids and gases in healthcare applications, Part 6: Connectors for neuraxial applications, published (Edition 1, 2016). https://www.iso.org/standard/50734.html. Accessed July 30, 2024.
- Article 2.4 of the TBT Agreement: Agreement on technical barriers to trade, technical regulations and dtandards, Article 2: Preparation, adoption and application of technical regulations by central government bodies, 1995. https://www.wto.org/english/docs_e/legal_e/17-tbt_e.htm. Accessed July 30, 2024
- Miyajima A. Pharmaceuticals and medical devices regulatory science policy research project: research on post-market safety measures for the safer and more effective use of new types of medical devices, etc. FY 2023 Summary and Joint Research Report (21KC2007). 2023 (In Japanese)
- Lefebvre PA, Meyer P, Lindsey A, et al. Unraveling a recurrent wrong drug-wrong route error— tranexamic acid in place of bupivacaine: a multistakeholder approach to addressing this important patient safety issue. APSF Newsletter. 2024;39:37,39–41. https://www.apsf.org/article/unraveling-a-recurrent-wrong-drug-wrong-route-error-tranexamic-acid-in-place-of-bupivacaine/. Accessed July 30, 2024.
- Institute for Safe Medication Practices (ISMP). Implement strategies to prevent persistent medication errors and hazards. ISMP Medication Safety Alert! Acute Care. 2023;28 (6):1–4. https://psnet.ahrq.gov/issue/implement-strategies-prevent-persistent-medication-errors-and-hazards Accessed July 30 2024.
- The distribution of new standard products (ISO80369-3) has been phased in starting from December 2019. https://www.pmda.go.jp/files/000246586.pdf. Accessed July 30 2024.


 Issue PDF
Issue PDF