 Les anesthésistes ont toujours été les leaders pour la sécurité des patients et ils reconnaissent depuis longtemps l’importance de l’hygiène des mains dans leur espace de travail.1 La contamination des mains est associée à la transmission de pathogènes entre de nombreux réservoirs présents dans l’espace de travail de l’anesthésie. La génomique des bactéries cultivées provenant des mains des soignants et des agents pathogènes infectieux a permis de confirmer que les soignants transmettent des pathogènes qui causent des infections chez les patients.2,3,4 La transmission du Staphylococcus aureus (S. aureus) entre les réservoirs de l’espace de travail de l’anesthésie est associée à un risque accru d’infection du site opératoire (ISO).5 En fait, le risque d’ISO est multiplié par cinq, voire plus, lorsque les pathogènes sont sensibles à l’antibiotique prophylactique utilisé et par neuf lorsque les pathogènes lui sont résistants.6 Afin de réduire ce risque, une approche multifactorielle est indiquée pour prévenir les ISO.7 Lorsque une meilleure hygiène des mains est intégrée à un programme multifactoriel, il est possible d’obtenir une réduction substantielle de la transmission du S. aureus et des ISO.8,9 Ces constatations devraient imprimer un élan d’améliorations généralisées du respect des règles de l’hygiène des mains par l’ensemble du personnel peropératoire, où les anesthésistes donnent l’exemple.
Les anesthésistes ont toujours été les leaders pour la sécurité des patients et ils reconnaissent depuis longtemps l’importance de l’hygiène des mains dans leur espace de travail.1 La contamination des mains est associée à la transmission de pathogènes entre de nombreux réservoirs présents dans l’espace de travail de l’anesthésie. La génomique des bactéries cultivées provenant des mains des soignants et des agents pathogènes infectieux a permis de confirmer que les soignants transmettent des pathogènes qui causent des infections chez les patients.2,3,4 La transmission du Staphylococcus aureus (S. aureus) entre les réservoirs de l’espace de travail de l’anesthésie est associée à un risque accru d’infection du site opératoire (ISO).5 En fait, le risque d’ISO est multiplié par cinq, voire plus, lorsque les pathogènes sont sensibles à l’antibiotique prophylactique utilisé et par neuf lorsque les pathogènes lui sont résistants.6 Afin de réduire ce risque, une approche multifactorielle est indiquée pour prévenir les ISO.7 Lorsque une meilleure hygiène des mains est intégrée à un programme multifactoriel, il est possible d’obtenir une réduction substantielle de la transmission du S. aureus et des ISO.8,9 Ces constatations devraient imprimer un élan d’améliorations généralisées du respect des règles de l’hygiène des mains par l’ensemble du personnel peropératoire, où les anesthésistes donnent l’exemple.
L’espace de travail de l’anesthésie est un environnement complexe qui inclut le patient, la table d’opération, l’appareil d’anesthésie, le ou les pieds de perfusion auxquels sont fixés les dispositifs de perfusion, un chariot avec des fournitures propres et les médicaments placés sur le chariot ou un poste distinct pour le stockage des médicaments. Les anesthésistes interagissent avec le patient et de nombreux éléments de leur espace de travail pendant une anesthésie de routine.10,11 Compte tenu de la complexité de cet environnement, la décontamination des mains est nécessaire pour empêcher les événements de transmission et réduire la propagation des infections. L’Organisation mondiale de la santé (OMS) définit les événements après lesquels l’hygiène des mains doit intervenir comme les « Cinq moments pour l’hygiène des mains ».12 Ces moments qui exigent une hygiène des mains sont les suivants : avant un contact avec un patient, avant un geste de nettoyage ou de désinfection, après un contact avec un patient, après un risque d’exposition à un fluide corporel et après un contact avec l’environnement d’un patient (Figure 1).12 Le respect des recommandations de l’OMS et d’autres recommandations semblables exigerait qu’un anesthésiste pratique l’hygiène des mains 54 fois par heure13 et jusqu’à 150 fois par heure.11,13 Cependant, les études révèlent que les anesthésistes pratiquent l’hygiène des mains moins d’une fois par heure.14 Il est donc clair que la situation est largement perfectible. On pourrait penser que la lutte contre la transmission des pathogènes est impossible, étant donnée l’omniprésence des bactéries dans notre environnement. Néanmoins, la recherche suggère que la réduction de S. aureus sur les mains des soignants à un niveau inférieur à 100 unités formant colonie (UFC) est un objectif réalisable qui peut contribuer à protéger nos patients.9,15
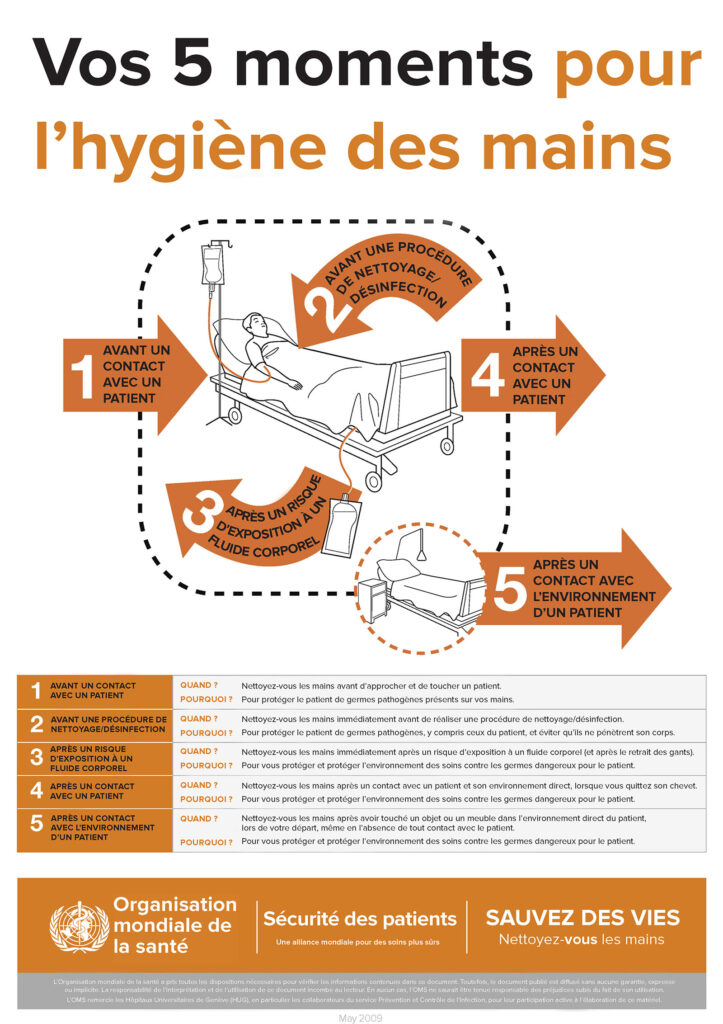
Figure 1 : Vos cinq moments pour l’hygiène des mains. Genève, Suisse. Organisation mondiale de la santé. 2009. Licence : CC BY-NC-SA 3.0 IGO.
Le Groupe de promotion des priorités de sécurité des patients de l’APSF : Maladies infectieuses recommande que les anesthésistes pratiquent l’hygiène des mains au moins huit fois environ par heure pendant les soins liés à l’anesthésie.16 Le lavage des mains ou l’emploi d’un désinfectant pour les mains à une fréquence de huit fois par heure réduisait de façon optimale la contamination environnementale et des robinets, ainsi que le développement ultérieur d’une infection.14 Cependant, la bonne méthode pour encourager le respect de l’hygiène des mains à cette fréquence n’est pas claire.16 Des études futures importantes comprennent les produits (p.ex. à base d’alcool ou l’eau et le savon), la localisation des distributeurs, la technique de nettoyage et les risques potentiels.
Alors qu’il est possible de décontaminer efficacement les mains au moyen de solutions à base d’alcool, les mains visiblement contaminées ou en contact potentiel avec des organismes sporulés doivent être décontaminées avec de l’eau et du savon.14,17 Étant donné que les lavabos chirurgicaux doivent obligatoirement se trouver à l’extérieur du bloc opératoire, les solutions hydroalcooliques sont la principale option d’hygiène des mains pour les anesthésistes. D’autre part, étant donné que ces solutions sont moins irritantes pour la peau que l’eau et le savon, elles peuvent réduire le risque de peau irritée, où la numération bactérienne est élevée.18,19
L’implantation des distributeurs doit être déterminée en fonction de la densité des tâches, autrement dit le nombre de tâches devant être réalisées dans un laps de temps donné. Les organisations chargées de la prévention des infections dans les établissements de santé recommandent une implantation dans des endroits faciles d’accès autour de la sphère de soins du patient.20 L’utilisation de distributeurs installés à l’extérieur de l’espace de travail de l’anesthésie (p.ex., sur le mur ou à proximité de l’entrée du bloc opératoire) pourrait perturber les soins apportés aux patients. L’importance de la densité des tâches est bien définie. Dans le cadre d’une étude, l’utilisation par les anesthésistes d’un distributeur de solution hydroalcoolique personnalisé, porté sur le corps, a permis de multiplier par 37 le respect des règles d’hygiène des mains. Cela a ainsi permis de réduire l’incidence de la contamination de l’environnement et des robinets, ainsi que les infections associées aux soins de santé.14 D’autres chercheurs ont évalué le positionnement du distributeur sur le pied de perfusion, à gauche du médecin, dans le cadre d’un programme multidimensionnel.8,9 Cela a permis de réduire le nombre de transmissions bactériennes et le développement ultérieur d’ISO.8,9
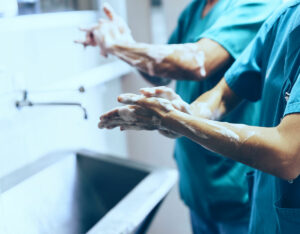
Du fait que la contamination des mains des médecins soit associée à la contamination environnementale, l’amélioration de la fréquence et de la qualité du nettoyage de l’environnement peut également compléter les efforts d’amélioration de l’hygiène des mains. Dans le cadre d’une étude, la séparation de l’espace de travail de l’anesthésie en zones « propres » et « sales » a permis de réduire le pourcentage de sites atteignant ≥ 100 CFU.14,21 Il est logique que les distributeurs de solution hydroalcoolique soient placés dans les zones désignées comme étant propres. Par exemple, le distributeur peut être fixé à l’appareil d’anesthésie ou au chariot sur un support ou sur le pied de perfusion. S’il est fixé au pied de perfusion, il est important de protéger le patient, le champ chirurgical et les prises électriques des éclaboussures et des gouttes (Tableau 1).
Tableau 1 : Considérations potentielles pour l’implantation des distributeurs de solution hydroalcoolique dans l’espace de travail de l’anesthésie.
Alors que les anesthésistes doivent pouvoir accéder facilement à un distributeur de solution hydroalcoolique, il faut tenir compte des risques. Toutes les solutions hydroalcooliques contiennent entre 60 et 80 % d’éthanol ou d’isopropanol et de l’eau. La raison de cette composition est qu’il faut une teneur en eau suffisante pour hydrolyser les membranes des microorganismes et ralentir l’évaporation du produit.22,23 Du fait de l’inflammabilité des produits hydroalcooliques, les codes de prévention des incendies régulent leur volume total autorisé dans une salle de procédure et la distance minimale entre les distributeurs. Les distributeurs doivent se trouver à une distance minimale de 1,2 m les uns des autres et leur volume total dans une seule et même pièce ne doit pas être supérieur à 1,2 litres.24 Les Centres pour le contrôle et la prévention des maladies adhèrent également à ces recommandations de sécurité incendie.25 Le volume pour les distributeurs de solution hydroalcoolique personnalisés et portés sur le corps et les pompes de solution hydroalcoolique manipulées d’une seule main sur un pied de perfusion est de moins de 85 g.8,9,14 Bien qu’aucun feu causé par des solutions hydroalcooliques n’ait été signalé, il convient de tenir compte de ce risque.
Pour résumer, l’amélioration de l’hygiène des mains des anesthésistes est un élément essentiel d’une approche multidimensionnelle pour réduire la transmission bactérienne et le développement des infections. Il faut encourager la pratique de l’hygiène des mains huit fois par heure pendant des soins courants dans le cadre d’une anesthésie. Les solutions hydroalcooliques dans l’espace de travail de l’anesthésie doivent être positionnées dans des lieux propres et faciles d’accès, clairement visibles par le médecin.
Jonathan E. Charnin, MD, FASA, Mayo Clinic, est professeur adjoint d’anesthésiologie, Département d’anesthésiologie et médecine périopératoire, Rochester, Minnesota.
Brendan T. Wanta, MD, Mayo Clinic, est professeur adjoint d’anesthésiologie, Département d’anesthésiologie et médecine périopératoire, Rochester, Minnesota.
Richard A. Beers, MD, est professeur émérite à SUNY Upstate Medical University, Syracuse, New York.
Jonathan M. Tan, MD, MPH, MBI, FASA, est professeur adjoint d’anesthésiologie clinique et sciences spatiales, vice-président de l’analyse des données et de l’efficacité clinique, département d’anesthésie-réanimation, Hôpital des enfants de Los Angeles, Université de Californie du Sud, Los Angeles, Californie.
Michelle Beam, DO, MBA, FASA, FACHE, est anesthésiste, Penn Medicine West Chester, West Chester, Pennsylvanie.
Sara McMannus, RN, BSN, MBA, est conseillère clinique, Sepsis Alliance
Desiree Chappell, MSNA, CRNA, est vice-présidente de la qualité clinique, NorthStar Anesthesia, Irving, Texas.
Randy W. Loftus, MD, Mayo Clinic, est professeur adjoint d’anesthésiologie, Département d’anesthésiologie et médecine périopératoire, Rochester, Minnesota.
Jonathan Tan bénéficie d’une bourse de recherche de l’Anesthesia Patient Safety Foundation et de la Foundation for Anesthesia Education and Research (FAER) et du Southern California Environmental Health Sciences Center. Il est consultant pour GE HEALTHCARE et Edwards Lifesciences.
Desiree Chappell fait partie du Bureau des conférenciers pour Medtronic et Edwards LifeSciences et siège au Comité consultatif de ProVation.
Randy Loftus signale un financement actuel pour ses recherches de NIH R01 AI155752-01A1, « L’essai BASIC : Améliorer la mise en œuvre d’approches et de surveillance fondées sur des données probantes pour prévenir la transmission et l’infection bactérienne » et il a reçu un financement de l’Anesthesia Patient Safety Foundation, Sage Medical Inc., B. Braun, Dräger, Surfacide et Kenall, est dans l’attente d’un ou plusieurs brevets, et il est associé de RDB Bioinformatics, LLC, une société qui est propriétaire d’OR PathTrac. Il a également participé à des conférences éducatives sponsorisées par Kenall et BBraun.
Les autres auteurs ne signalent aucun conflit d’intérêts.
DOCUMENTS DE RÉFÉRENCE
- Warner MA, Warner ME. The evolution of the anesthesia patient safety movement in America: lessons learned and considerations to promote further improvement in patient safety. Anesthesiology. 2021;135:963–974. PMID: 34666350
- Dexter F, Loftus RW. Estimation of the contribution to intraoperative pathogen transmission from bacterial contamination of patient nose, patient groin and axilla, anesthesia practitioners’ hands, anesthesia machine, and intravenous lumen. J Clin Anesth. 2024;92:111303. Epub 2023 Oct 22. PMID: 37875062.
- Loftus RW, Brindeiro CT, Loftus CP, et al. Characterizing the molecular epidemiology of anaesthesia work area transmission of Staphylococcus aureus sequence type 5. J Hosp Infect. 2024;143:186–194. Epub 2023 Jul 13. PMID: 37451409.
- Loftus RW, Brown JR, Koff MD, et al. Multiple reservoirs contribute to intraoperative bacterial transmission. Anesth Analg. 2012;114:1236–1248. Epub 2012 Mar 30. PMID: 22467892.
- Hopf, Harriet W. MD. Bacterial reservoirs in the operating room. Anesthesia & Analgesia. 2015;120:p 700–702. PMID: 25790198
- Loftus RW, Dexter F, Brown JR. Transmission of Staphylococcus aureus in the anaesthesia work area has greater risk of association with development of surgical site infection when resistant to the prophylactic antibiotic administered for surgery. J Hosp Infect. 2023;134:121–128. doi: 10.1016/j.jhin.2023.01.007. Epub 2023 Jan 21. PMID: 36693592.
- Dexter F, Brown JR, Wall RT, Loftus RW. The efficacy of multifaceted versus single anesthesia work area infection control measures and the importance of surgical site infection follow-up duration. J Clin Anesth. 2023;85:111043. Epub 2022 Dec 23. PMID: 36566648.
- Loftus RW, Dexter F, Goodheart MJ, et al. The effect of improving basic preventive measures in the perioperative arena on Staphylococcus aureus transmission and surgical site infections: a randomized clinical trial. JAMA Netw Open. 2020;3: e201934. PMID: 32219407
- Wall RT, Datta S, Dexter F, et al. Effectiveness and feasibility of an evidence-based intraoperative infection control program targeting improved basic measures: a post-implementation prospective case-cohort study. J Clin Anesth. 2022; 77:110632. Epub 2021 Dec 17. PMID: 34929497.
- Sharma A, Fernandez PG, Rowlands JP, et al. Perioperative infection transmission: the role of the anesthesia provider in infection control and healthcare-associated infections. Curr Anesthesiol Rep. 2020;10:233–241. Epub 2020 Jul 17. PMID: 32837343
- Rowlands J, Yeager MP, Beach M, et al. Video observation to map hand contact and bacterial transmission in operating rooms. Am J Infect Control. 2014;42:698–701. PMID: 24969122
- WHO guidelines on hand hygiene in health care: first global patient safety challenge clean care is safer care. Geneva: World Health Organization; 2009. 21, The WHO Multimodal Hand Hygiene Improvement Strategy. Available from: https://www.who.int/publications/i/item/9789241597906. Accessed July 5, 2024
- Biddle C, Shah J. Quantification of anesthesia providers’ hand hygiene in a busy metropolitan operating room: what would Semmelweis think? Am J Infect Control. 2012;40:756–759. Epub 2012 Feb 9. PMID: 22325482.
- Koff MD, Loftus RW, Burchman CC, et al. Reduction in intraoperative bacterial contamination of peripheral intravenous tubing through the use of a novel device. Anesthesiology. 2009;110:978–985. PMID: 19352154.
- Dexter F, Walker KM, Brindeiro CT, et al. A threshold of 100 or more colony-forming units on the anesthesia machine predicts bacterial pathogen detection: a retrospective laboratory-based analysis. Can J Anaesth. 2024;71:600–610. English. Epub 2024 Feb 27. PMID: 38413516.
- Charnin JE, Hollidge M, Bartz R, et al. A best practice for anesthesia work area infection control measures: what are you waiting for? APSF Newsletter. 2022;37:103-106. https://www.apsf.org/article/a-best-practice-for-anesthesia-
work-area-infection-control-measures-what-are-you-waiting-for/ Accessed August 9, 2024. - WHO guidelines on hand hygiene in health care: first global patient safety challenge clean care is safer care. Appendix 2. Guide to appropriate hand hygiene in connection with Clostridium difficile spread. https://www.ncbi.nlm.nih.gov/books/NBK144042/. Accessed May 29, 2024.
- Pedersen LK, Held E, Johansen JD, Agner T. Short-term effects of alcohol-based disinfectant and detergent on skin irritation. Contact Dermatitis. 2005;52:82–87. PMID: 15725285
- Larson EL, Hughes CA, Pyrek JD, et al. Changes in bacterial flora associated with skin damage on hands of health care personnel. Am J Infect Control. 1998;26:513–521. PMID: 9795681
- Glowicz JB, Landon E, Sickbert-Bennett EE, et al SHEA/IDSA/APIC practice recommendation: strategies to prevent healthcare-associated infections through hand hygiene: 2022 update. Infect Control Hosp Epidemiol. 2023;44:355–376. PMID: 36751708
- Clark C, Taenzer A, Charette K, Whitty M. Decreasing contamination of the anesthesia environment. Am J Infect Control. 2014 Nov;42(11):1223-5. Epub 2014 Oct 30. PMID: 25444268.
- Ali Y, Dolan MJ, Fendler EJ, Larson EL. Alcohols. In: Block SS, ed. Disinfection, sterilization, and preservation. Philadelphia: Lippincott Williams & Wilkins, 2001:229–254.
- Rutala WA, Weber DJ, and the Healthcare Infection Control Practices Advisory Committee. Guideline for disinfection and sterilization in healthcare facilities, 2008. https://stacks.cdc.gov/view/cdc/47378 Accessed August 9, 2024.
- National Fire Protection Association (NFPA). NFPA 101 Life Safety Code. 2018 edition. Quincy, MA: National Fire Protection Association; 2018. https://www.nfpa.org/codes-and-standards/all-codes-and-standards/list-of-codes-
and-standards/detail?code=101 Accessed August 9, 2024. - Centers for Disease Control and Prevention (CDC). Clinical safety: hand hygiene for healthcare workers – fire safety and Alcohol-Based Hand Sanitizer (ABHS). https://www.cdc.gov/clean-hands/hcp/clinical-safety/?CDC_AAref_Val=https://www.cdc.gov/handhygiene/firesafety/index.htm Accessed July 5, 2024.


 Issue PDF
Issue PDF