Cet article présente un cas d’hyperthermie maligne (HM) et les différentes manières par lesquelles les anesthésistes peuvent améliorer la prise en charge des patients dans la gestion du syndrome avant le bloc opératoire. Nous introduisons un concept intitulé les « 4C de la gestion de la HM ».
INTRODUCTION
En tant qu’anesthésiste, vous savez très probablement que l’hyperthermie maligne (HM) survient sans prévenir et peut rapidement entraîner une rigidité musculaire, une hyperthermie, une élévation du CO2 expiré, une acidose respiratoire et métabolique et si elle n’est pas traitée rapidement et spécifiquement, elle peut causer la mort. Vous savez aussi peut-être que, bien que l’HM se transmette sur un mode autosomique dominant, elle est plus courante chez les hommes que les femmes et le syndrome a un taux plus élevé chez les enfants que les adultes.1
Nous présentons ici un cas récent d’HM et nous reprenons l’historique de la contribution des anesthésistes pour améliorer notre compréhension de l’HM. Nous proposons également une orientation future dans laquelle nous pourrions aussi jouer un rôle majeur, dans le cadre de la prise en charge des patients longtemps après un épisode aigu, afin de veiller à établir un bilan correct et comprendre les séquelles.
UN CAS D’HM
Une jeune fille de 11 ans, en bonne santé, se présente à l’hôpital pour une coelioscopie d’un tératome ovarien découvert fortuitement. Elle n’avait jamais eu de chirurgie ni d’anesthésie. Peu après l’induction de l’anesthésie au sévoflurane, la curarisation au rocuronium et l’intubation, elle a développé une tachycardie persistante (fréquence cardiaque de 120 bpm avec une fréquence initiale dans les 80 bpm), sa température est montée à 39,4 °C et son CO2 expiré (ETCO2) a atteint 110 mmHg. Une rigidité musculaire a également été constatée au niveau des bras de la patiente, malgré l’administration d’un bloc neuromusculaire non dépolarisant. Dès que ces signes d’HM sont apparus, de l’aide a été demandée pour gérer la crise. Le sévoflurane a été interrompu et du Ryanodex® (dantrolène sodique, Eagle Pharmaceuticals, Inc., Woodcliff Lake, New Jersey, États-Unis) a été rapidement administré. Au bout de quelques minutes, sa fréquence cardiaque, sa température, son CO2 expiré et son tonus musculaire se sont tous améliorés. D’autres mesures de stabilisation ont été prises, dont la mise en place d’une anesthésie totale intraveineuse (ATIV), la mise en place d’un accès intraveineux supplémentaire et d’un cathéter artériel, un refroidissement actif avec l’administration d’une perfusion froide et une hydratation agressive. Une fois stabilisée, la chirurgie a été rapidement terminée et la patiente a été transférée en réanimation. Le traitement au dantrolène a été poursuivi. Il faut noter que sa première créatine kinase (CK) était anormalement élevée à 34 000 UI. La patiente a été extubée le lendemain. Au cours des jours suivants, son état a continué de s’améliorer et les symptômes associés à sa rhabdomyolyse ont disparu.
Au cours de nombreuses visites pendant les journées qui ont suivi cet événement, les anesthésistes ont appris que la patiente avait déjà eu des épisodes d’intolérance à la chaleur. On avait également découvert de manière fortuite un taux de CK chroniquement élevé chez sa grand-mère, qui n’avait toutefois pas eu de biopsie musculaire. Des tests génétiques complets sur 129 gènes associés à la rhabdomyolyse et la myopathie métabolique ont été prescrits, ainsi qu’une consultation avec un généticien et un neurologue. Les tests génétiques ont révélé une altération du récepteur de la ryanodine (RYR1), confirmant le diagnostic d’HM. Il est intéressant de souligner qu’elle avait un variant du gène RYR1. Celui-ci est officiellement classé comme variant de signification inconnue (VSI) par le National Human Genome Institute et l’American College of Medical Genetics, toutefois il est considéré comme variant pathogène par le European MH Group. Il a déjà été associé à des niveaux de CK élevés, une rhabdomyolyse et une faiblesse.2 Elle a finalement quitté l’hôpital au cinquième jour avec un suivi rigoureux par les services de génétique médicale, de neurologie et des maladies neuromusculaires.
HM : UNE RÉUSSITE
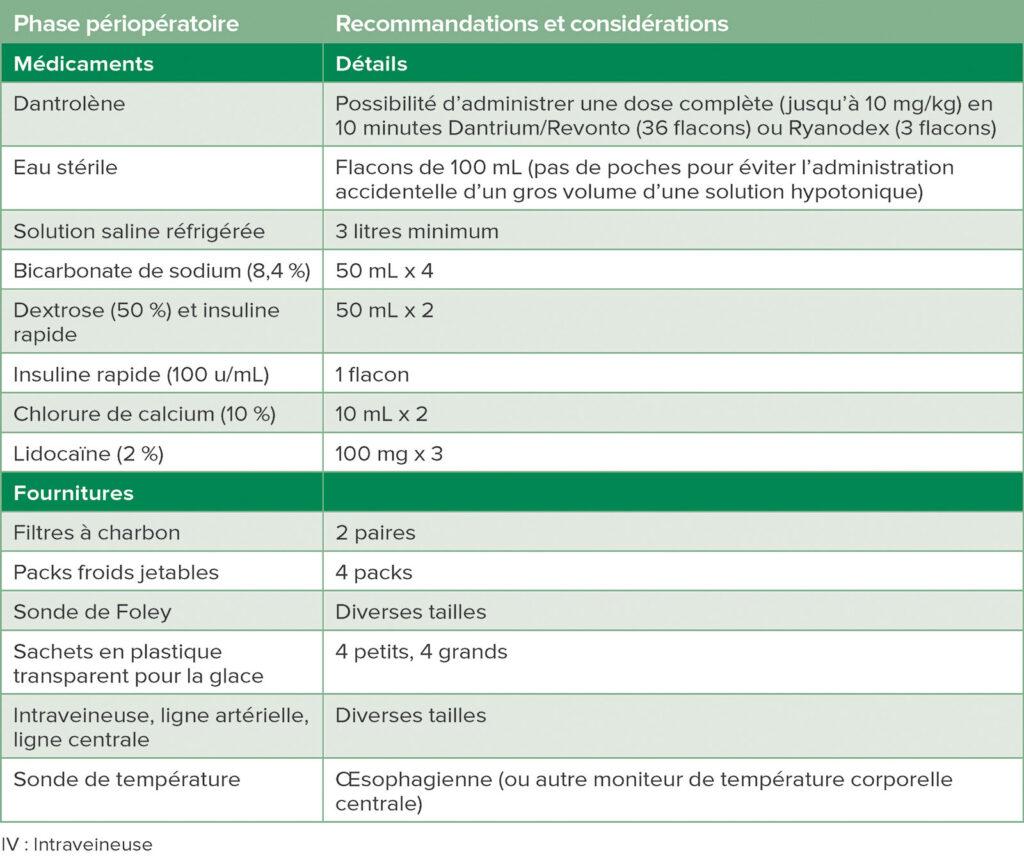
Cette histoire d’une patiente qui développe une HM et bénéficie d’un diagnostic et d’un traitement appropriés reflète le cumul de connaissances issues des recherches scientifiques depuis plusieurs années, réalisées dans le monde entier. Depuis la première description d’HM à Melbourne, en Australie, en 1960 par Denborough et Lovell, d’immenses progrès ont été réalisés en termes de définition de la physiopathologie, de la découverte d’une prise en charge thérapeutique efficace et la diffusion d’informations sur l’HM aux anesthésistes.3 La mortalité liée à l’HM est passée de 70 % à environ 10 % dans les pays préparés à ce syndrome et disposant d’un accès au dantrolène et autres matériels (Tableau 1),4 d’une approche coordonnée du diagnostic et de la gestion, y compris l’observation en réanimation, et la coordination post-épisode avec les membres de la famille de la personne atteinte d’HM.
Tableau 1 : Médicaments et matériels de chariot pour HM.
ORIENTATIONS FUTURES
Comme souvent dans le domaine des sciences, la résolution d’un problème conduit souvent à d’autres questions. Dans le cadre de la recherche de solutions à ces questions, il est devenu évident qu’il ne faut pas considérer que l’HM est un trouble épisodique singulier, mais un trouble pharmacogénétique et une myopathie congénitale, dont les conséquences sont très éloignées de la sphère de l’anesthésie.
Premièrement, que savons-nous des implications des mutations du gène RYR1 en dehors de l’HM ? Il faudra mener d’autres études pour comprendre le lien entre les maladies associées au gène RYR1 (telles que la myopathie induite par les statines, la rhabdomyolyse d’effort, les AVC et une élévation chronique de la CK) et la susceptibilité à l’HM (SHM).5 Il est également nécessaire de comprendre le rôle et l’efficacité du dantrolène dans le traitement de ces autres syndromes.
Deuxièmement, après un épisode d’HM, comment confirmer un diagnostic de SHM ? Grâce aux progrès dans le domaine des tests génétiques pour évaluer la SHM, l’analyse génétique a essentiellement remplacé les tests de contracture musculaire sur biopsie musculaire à l’halothane et à la caféine, presque partout dans le monde. En 2015, la société Européenne HM a officiellement modifié sa recommandation d’utilisation de l’analyse génétique comme test de première intention dans le diagnostic de la SHM et la plupart de experts en HM à travers le monde ont suivi cet exemple.6 Aux États-Unis, il existe seulement deux centres (dans les États du Minnesota et de Caroline du Nord) et les tests, qui en règle générale ne sont pas remboursés par les compagnies d’assurance, peuvent coûter jusqu’à 20 000 dollars US. Par ailleurs, le coût des tests génétiques a baissé de plus de 99 % depuis le premier séquençage du génome humain et il est généralement remboursé par les compagnies d’assurance. Les coûts spécifiques varient selon le type de test. Un test complet de trois gènes associés à la SMH (RYR1, CACNA1S et STAC3) coûte moins de 500 USD,7 alors que le coût d’un test plus complet d’une myopathie métabolique est de l’ordre de 1.500 USD.8
Troisièmement, quel est le rôle de l’anesthésiste dans la prise en charge des patients atteints de SHM après leur épisode et quelles doivent être leurs interactions avec d’autres professionnels tels que des généticiens et des neurologues ? Qui est responsable de conseiller les membres de la famille à propos de la signification d’un variant pathogène de l’ADN prédisposant à la HM ? Les spécialistes qui traitent des patients qui ont subi un épisode de HM peuvent les aider à comprendre s’ils peuvent s’attendre à un rétablissement complet, mais il est possible qu’ils soient moins en mesure de répondre à des questions sur le plus long terme, comme de savoir si ces patients sont prédisposés à la rhabdomyolyse ou à des faiblesses musculaires, et pendant combien de temps. Il convient de garantir une méthode permettant de signaler dans le dossier médical électronique un diagnostic de SHM, y compris un variant génétique spécifique. L’intelligence artificielle ou les services tiers qui peuvent traiter les données de plusieurs plateformes de tests génétiques et améliorer la communication aux soignants de ce diagnostic critique peut rendre la prise en charge des patients atteints de SHM plus sûre. Bien que l’incidence de l’HM aiguë chez les patients atteints de SHM exposés à des facteurs déclencheurs soit inconnu et difficile à estimer, tous les patients atteints de SHM devraient être pris en charge à l’aide d’une technique d’anesthésie « propre », sans facteur déclencheur.9-11 Il s’agit notamment d’éviter la succinylcholine et les agents anesthésiques volatiles, de préparer l’appareil d’anesthésie en vidangeant le circuit et le ventilateur à l’aide de grandes quantités de fluide pendant la durée de temps recommandée par le fabricant ou d’insérer des filtres au charbon actif dans le circuit respiratoire, d’utiliser un absorbeur propre de CO2 et de fermer les vaporisateurs à l’aide d’un ruban adhésif pour éviter une utilisation accidentelle. Les moniteurs peropératoires doivent inclure un électrocardiogramme, l’oxymétrie, la mesure de la pression artérielle, de la température corporelle centrale et une capnographie pour une anesthésie générale.12
Enfin, l’HM a été signalée dans de nombreux pays à travers le monde et il n’existe aucune propension ethnique connue au SHM. Une préoccupation plus large en termes de santé publique est de savoir quelle méthode les pays aux ressources limitées doivent utiliser pour trouver l’équilibre entre le dantrolène qui sauve des vies pour un trouble peu fréquent et la nécessité de dépenser de l’argent pour des troubles plus fréquents. Un rapport chinois dans le numéro de février 2024 du journal Anesthesiology signalait une mortalité de plus de 50 % en lien avec l’HM dans les régions sans dantrolène.13 Aux États-Unis, la question s’est posée de savoir si les centres de soins ambulatoires qui n’utilisent pas systématiquement des agents volatils et réservent la succinylcholine pour la prise en charge en urgence des voies aériennes devaient stocker du dantrolène. Cependant, des données montrent que stocker du dantrolène est à la fois rentable et optimal pour la prise en charge des patients lorsque des agents déclencheurs sont susceptibles d’être utilisés.14-17
LES QUATRE « C » DE LA GESTION DE L’HM
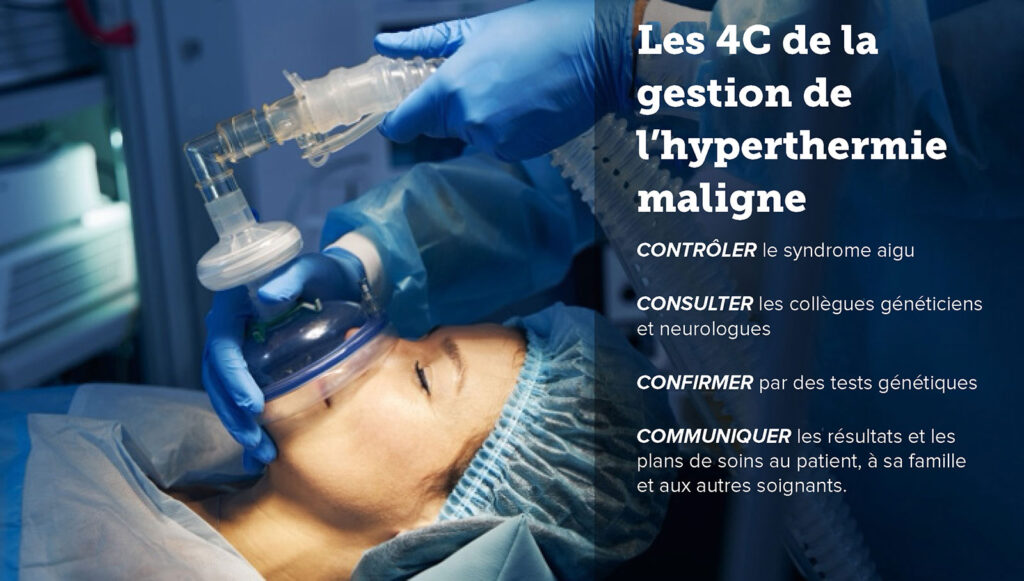
Nous pensons qu’il est temps d’élargir nos perspectives à propos du syndrome d’HM pour considérer que le problème n’est pas unique au domaine de l’anesthésie et de la chirurgie. Nous devons étendre les objectifs de prise en charge des patients au-delà du cadre de gestion d’un épisode d’HM aiguë, pour inclure un suivi adapté et une évaluation d’autres troubles musculosquelettiques potentiellement associés. Une approche multidisciplinaire du diagnostic, du traitement et des conseils génétiques pour les patients et leur famille est d’une importance primordiale. Par conséquent, nous proposons la règle des 4 C dans la gestion de l’HM :
- Contrôler le syndrome aigu
- Consulter les collègues généticiens et neurologues
- Confirmer par des tests génétiques
- Communiquer les résultats et les plans de soins au patient, à sa famille et aux autres soignants.
ÉTAPES SUIVANTES
Il est de notre ressort, en tant que professionnels de l’anesthésie, de prendre ces mesures afin d’améliorer la prise en charge des patients atteints de SHM. La gestion éclairée de l’HM correspond aux objectifs de l’APSF et d’autres organisations en faveur de la sécurité des patients. Les étapes suivantes seront notamment : 1) la mise à jour des recommandations concernant les tests de diagnostic de la SHM par la Malignant Hyperthermia Association of the United States (MHAUS) afin d’inclure les tests génétiques dans tous les cas où l’HM est suspectée, 2) la création d’un système pour mettre en relation les anesthésistes qui gèrent l’HM et des généticiens cliniques, des plateformes de tests génétiques et des neurologues qui connaissent l’HM, 3) l’assurance de la communication d’un diagnostic de SHM aux dossiers médicaux électroniques et 4) la diffusion d’informations sur l’HM à l’échelle mondiale, notamment en faveur de stocks de dantrolène dans les centres pouvant utiliser des agents déclencheurs.
Henry Rosenberg, MD, est président émérite de la Malignant Hyperthermia Association of the United States (MHAUS).
Anjan Saha, MD, est interne en 3e année d’anesthésie clinique (CA3) (Programme Apgar Scholars) à Columbia University, New York, New York.
Carla D. Zingariello, DO, est professeure adjointe de pédiatrie à College of Medicine de l’Université de Floride, Gainesville, Floride.
Sandra Natalia Gonzalez, MD, FAAP, est professeure adjointe d’anesthésie à College of Medicine de l’Université de Floride, Gainesville, Floride.
Teeda Pinyavat, MD, est professeure associée d’anesthésie à Columbia University, New York, New York.
Henry Rosenberg, MD siège comme président émérite de MHAUS et membre du conseil d’administration de MHAUS
Anjan Saha, MD détient des actions dans une start-up du nom de Deoxylytics. Deoxylytics est une société en pharmacogénomique.
Carla Zingariello, DO est chercheuse principale pour un essai clinique avec ML Bio et elle a été consultante pour ML Bio.
Sandra Natalia Conzalez, MD, ne signale aucun conflit d’intérêts.
Teeda Pinyavat, MD, est membre du conseil d’administration de MHAUS.
DOCUMENTS DE RÉFÉRENCE
- Rosenberg H, Pollock N, Schiemann A, et al. Malignant hyperthermia: a review. Orphanet J Rare Dis. 2015;10:93. PMID: 26238698
- Witting N, Laforêt P, Voermans NC, et al. Phenotype and genotype of muscle ryanodine receptor rhabdomyolysis-myalgia syndrome. Acta Neurol Scand. 2018;137:452–461. PMID: 29635721
- Denborough MA. Malignant hyperthermia. 1962. Anesthesiology. 2008;108:156–157.
- Malignant Hyperthermia Association of the United States (MHAUS) Professional Advisory Council. “What should be on an MH cart?” MHAUS.org. https://www.mhaus.org/healthcare-professionals/be-prepared/what-should-be-on-an-mh-cart/. Accessed July 20, 2024.
- Fiszer D, Shaw MA, Fisher NA, et al. Next-generation sequencing of RYR1 and CACNA1S in malignant hyperthermia and exertional heat illness. Anesthesiology. 2015;122:1033–1046. PMID: 25658027
- Hopkins PM, Rüffert H, Snoeck MM, et al. on behalf of European Malignant Hyperthermia Group. European Malignant Hyperthermia Group guidelines for investigation of malignant hyperthermia susceptibility. Br J Anaesth. 2015;115:531–539. PMID: 26188342
- “Invitae Malignant Hyperthermia Susceptibility Panel.” Invitae. https://www.invitae.com/us/providers/test-catalog/test-03285. Accessed July 20, 2024.
- “Metabolic Myopathy and Rhabdomyolysis Panel.” Blueprint Genetics. https://blueprintgenetics.com/tests/panels/neurology/metabolic-myopathy-and-rhabdomyolysis-panel/. Accessed July 20, 2024.
- Ibarra Moreno CA, Hu S, Kraeva N, et al. An assessment of penetrance and clinical expression of malignant hyperthermia in individuals carrying diagnostic ryanodine receptor 1 gene mutations. Anesthesiology. 2019;131:983–991. PMID: 31206373
- Shaw MA, Hopkins PM; Mission impossible or mission futile?: estimating penetrance for malignant hyperthermia. Anesthesiology. 2019;131:957–959. PMID: 31335544
- Yu KD, Betts MN, Urban GM, et al. Evaluation of malignant hyperthermia features in patients with pathogenic or likely pathogenic RYR1 variants disclosed through a population genomic screening program. Anesthesiology. 2024; 140:52–61. PMID: 37787745
- Rüffert H, Bastian B, Bendixen D, et al. European Malignant Hyperthermia Group. Consensus guidelines on perioperative management of malignant hyperthermia suspected or susceptible patients from the European Malignant Hyperthermia Group. Br J Anaesth. 2021;126:120–130. PMID: 33131754
- Yu H, Tan L, Deng X. Improving dantrolene mobilization in regions with limited availability. Anesthesiology. 20241;140:1201–1202. PMID: 38329334
- Joshi GP, Desai MS, Gayer S, Vila H Jr. Society for Ambulatory Anesthesia (SAMBA). Succinylcholine for emergency airway rescue in class B ambulatory facilities: the Society for Ambulatory Anesthesia position statement. Anesth Analg. 2017;124:1447–1449. PMID: 27984222
- Litman RS, Smith VI, Larach MG, et al. Consensus statement of the Malignant Hyperthermia Association of the United States on unresolved clinical questions concerning the management of patients with malignant hyperthermia. Anesth Analg. 2019;128:652–659. PMID: 30768455
- Larach MG, Klumpner TT, Brandom BW, et al.; Multicenter Perioperative Outcomes Group. Succinylcholine use and dantrolene availability for malignant hyperthermia treatment: database analyses and systematic review. Anesthesiology. 2019;130:41–54. PMID: 30550426
- Aderibigbe T, Lang BH, Rosenberg H, et al. Cost-effectiveness analysis of stocking dantrolene in ambulatory surgery centers for the treatment of malignant hyperthermia. Anesthesiology. 2014;120:1333–1338. PMID: 24714119


 Issue PDF
Issue PDF