術中低血圧(intraoperative hypotension, IOH)と負の術後転帰の関連を裏付ける証拠が増えている。最も顕著なのは急性腎障害(acute kidney injury, AKI)、非心臓手術後の心筋障害、および死亡である。最近の研究ではIOHとせん妄、脳卒中、再入院との関連性も示されている。IOHに関連する合併症は、患者と医療システムに広範囲にわたる影響を及ぼす。IOHは改善可能なリスクであり、それに対するアプローチは、許容し続けることができない重大な実践的変動に関連している。
患者から麻酔専門家によくある要望は、「十分注意してほしい」というものである。私たちは自信を持って「そうします」と答えるかもしれないが、多くの麻酔専門家は、術中低血圧(intraoperative hypotension, IOH)と患者の合併症および死亡率に関連するデータが増えていることに気づいていない可能性がある。IOHと負の術後転帰との関連を裏付ける証拠が増えている。最も顕著なのは急性腎障害(acute kidney injury, AKI)、非心臓手術後の心筋障害、死亡である。1-9 最近の研究ではIOHとせん妄、脳卒中、再入院との関連性も示されている。1,4,9-11 IOHに関連する合併症は、患者と医療システムに広範囲にわたる影響を及ぼす。急性腎障害だけでも、脳卒中、心筋障害、慢性腎臓病などのさらなる合併症発症、入院死亡率および1年以内の死亡率、さらには入院期間、医療資源の利用、医療費増加に関連している。4,12,13 麻酔専門家は、特に術後の転帰データを受け取っていない場合、これらの憂慮すべき転帰に気づいていない可能性がある。研究結果は患者への危害を避けるために、IOHを減らす必要があることを示唆している。
術中低血圧は、臓器灌流低下につながる「安全な閾値」を下回る血圧(blood pressure, BP)として定義できる。1-9 IOH発生率は、使用される定義によって異なり、血圧低下とその低下期間の両方が含まれる場合いがある。IOHとAKIおよび心筋障害の転帰との関係を評価した研究では、2 ベースラインからの相対的な低下(術前血圧の 20%低下)と、絶対閾値の低下の両方をIOHと定義し評価した。絶対閾値と相対閾値が、心筋障害または腎障害を起こす患者と起こさない患者を判別するのに同等であることを見出し、絶対閾値が使用できることを示唆している。平均動脈圧(Mean arterial pressures, MAP)< 65mm Hgが1分間続くことは、AKIおよび心筋障害のリスク上昇と関連していた。2 AKIおよび心筋障害の発症リスクは、IOH持続時間が長くなるほど増加した。2 この知見からは、IOHは65mm Hg未満のMAPが少なくとも1分間続くことと定義された。2
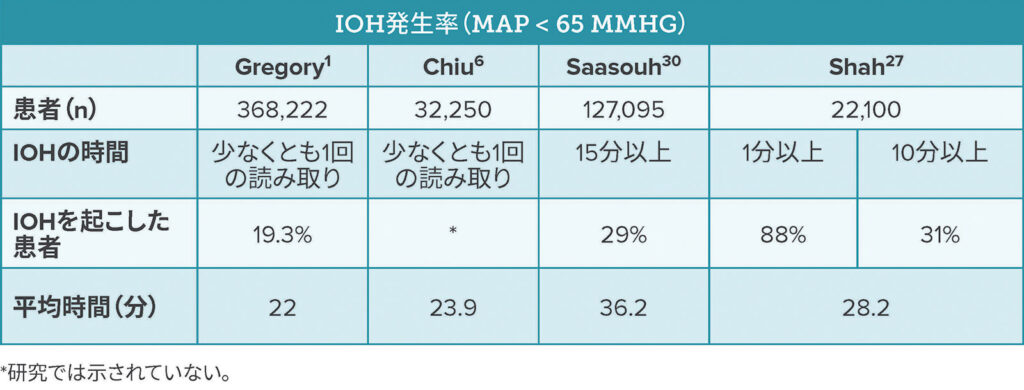
2017年から2022年末までに発行されたIOHに関する入手可能な文献を、関連する最近の研究と合わせてレビューしたところ、IOHの最も一般的な定義は、いずれかの時点でMAP < 65mm Hg1,4,6,10,14-18、あるいは65 mmHgが1分以上であることが示唆されている。8,10,19-26 この絶対 MAP閾値を使用するとIOHは驚くほど一般的に起きている。22,000人を超える患者を対象とした最近の多施設共同後方視的観察研究では、非心臓手術患者の88%が少なくとも1回のIOHエピソードを経験し、平均28.2分であった(表1)。27 11件の医療センターで、IOH対策に大きなばらつきがあることが指摘され、IOHに対する医療提供者の許容範囲に差があることが示唆された。27
表 1:4研究間のIOH発生率の比較
The Centers for Medicare and Medicaid Services (CMS)は、Merit-Based Incentive Payment System(MIPS:医療において、医師への償還方式に関して、当事者のインセンティブに着目して報酬を与える償還方式)の基準として、65mm Hg未満のMAPが15分以上続くことと定義した新しいIOH品質基準を認めている。28 全体的なIOH測定スコアが低いほど、定義されたMAPよりも低値の時間が短いことを示す。28 MIPSスコアは、品質、改善活動、相互運用性の促進、およびコストのパフォーマンス測定に基づいて合計される。ePreop31測定は、MIPSスコアの品質部分に提出できる6つの麻酔に関する測定項目のうちの1つである。28,29 最終MIPSスコアによって、メディケアパートBの請求に適用される支払いが決定される。29 CMSのMIPSのIOH定義を使用した最近の研究では、ある集団の麻酔業務におけるIOH発生率は、非心臓手術では29%であった。30 この研究では、臨床医の間でIOH発生率が異なることが判明し、IOH管理における対応のばらつきの減少を促進する必要性の証拠が追加された。14,30,31 著者らはIOHを改善可能なリスクと考え、IOHへの慣れを減らすために、品質改善の取り組みを進めることを提案した。30
IOH の定義に関係なく、共通の課題は、低血圧の程度がより重度であり、低血圧の累積時間が長いほど、患者の合併症および死亡率の増加と関連しているということである。多くの研究は、長時間のMAP < 65mm Hgまたは時間にかかわらずMAP ≤ 55mm Hgは、予後不良リスクの増加と関連していることを示している。1-3,9,16,17,32 したがって、簡単に言えば、我々はIOH の発生、重症度、期間を最小限に抑える必要がある。
アームカフを使用した従来の間欠的な血圧(intermittent oscillometric BP, IOBP)測定法を使用する場合、IOHを減らすのは困難かもしれない。IOBP測定では、血圧変化や低血圧エピソードの検出の遅れまたは見逃し、血行動態の極端な上昇時の不正確さ、低血圧時の血圧の過大評価があり、その結果、実際よりも重篤なエピソードが発生する可能性がある。19,33 IOBP による測定で低血圧イベントを見逃す可能性は、設定した測定頻度や生理学的モニターの基本設定によって異なる。ある最近の研究では、IOBP測定の最も一般的な設定頻度は2~5分ごとであることが判明した。25 これらの頻度では、測定間の低血圧が検出されずに蓄積され、患者が危害を被るリスクが増大する可能性があり、連続的にモニタリングすることで最小限にすることができる。15,19,25
新たな研究では、連続的な血圧モニタリングの使用を支持しており、血圧変動の減少16、血行動態の安定性向上33、IOBPによって見逃された低血圧エピソードの検出19、IOHの早期発見と治療15,25、およびIOHの全体的な減少など、IOBPを超えるいくつかの利点があるとしている。15,19,25,33 連続的な血圧モニタリングは、動脈圧モニタリングを使用して侵襲的に行うことができるが、感染、神経損傷、血栓、仮性動脈瘤などのリスクが伴う。25 指カフを使用した連続的な非侵襲性血圧モニタリングは、侵襲的動脈圧測定に関連するリスクを回避し、同等のMAP値を提供できる。25,33 この技術の限界としては、IOBPに比べて追加コストがかかること、高齢患者やアテローム性動脈硬化症患者では精度が低下する可能性があることが挙げられる。25,34,35 最近の研究で報告されている非侵襲的指カフは、指の動脈にかかるカフの圧力を変化させて一定の容積を維持するボリュームクランプ技術を採用している。25,33 指の動脈圧は動脈波形に再構築され、脈波解析が可能となり、IOHの原因の特定に役立つ高度な血行力学変数(例: 一回拍出量、心拍出量、一回拍出量変動)が得られる。25 非侵襲的指カフは、外科手術中に動脈血サンプルが必要ない場合、連続的な血圧モニタリングに適した選択枝となる。33
臨床医はIOH発生、重症度、時間を最小限に抑えるべきである
不適切な輸液や昇圧薬の使用は臓器血流低下引き起こし、臓器障害を引き起こす可能性があり、これらの問題を回避するための計画的戦略の重要性が強調されている。1,3,6,7,12,32 Ariyarathnaらは、IOHとは関係なく、昇圧薬の大量使用と術後 AKI との関係を報告した。12 別の研究では、ERAS プロトコルによる水分制限の実施が術後低血圧の大幅な増加と関連していることが示唆された。31 この研究では、術後低血圧となった患者はまた、顕著なIOHを経験しており、術中輸液総量が少なかった。32,000人を超える腹部手術患者を対象とした、Multicenter Perioperative Outcomes Group (MPOG)施設からの、過去5年間の多施設共同後方視的研究では、全体的なIOHの減少にも関わらず、AKI発生率の増加が観察された。更に、6 術中の輸液投与量の減少と昇圧薬の使用増加があり、どちらもAKI発生率の増加と関連していた。晶質液の投与量が1 mL/kg/hrから10 mL/kg/hrに増加すると、AKIリスクが58%減少した。この劇的な結果は、輸液投与量を最小限に抑えながら血圧を維持するために昇圧薬に依存すると、すでに損なわれている内臓や腎臓の灌流が低下し、腸閉塞、術後の悪心や嘔吐、手術部位感染症、AKIなど医原性の有害事象を引き起こす可能性があるという生理学的概念を裏付けるものである。6,7,12,36
IOHの原因は多因子であり、心筋収縮力の低下、血管拡張、循環血液量減少、徐脈、心腔の外因性圧迫(心嚢液貯留や気胸など)または複数の血行力学的変化によって説明される「混合型」が含まれる。8,18 高度な血行力学変数(例: 一回拍出量、心拍出量、一回拍出量変動)を提供するモニターの使用は、低血圧の予防、診断、治療に有益である可能性がある。8介入は、単に生理学的モニターに表示されるMAP数値を改善するのではなく、目標指向療法(goal-directed therapy, GDT)戦略を使用して、IOHの根本原因に的を絞ることができる。
GDTという用語は、高度な血行力学モニターを使用して、輸液、強心薬、昇圧薬を最適なタイミングで最適に投与することを表す包括的な用語として概念化できる。GDT戦略における術中介入は、組織への酸素供給を最適化し、臓器低灌流を防ぐという特定のエンドポイントまたは目標を目指している(図 1)。5,17 血行力学モニターは、これらの介入に対する患者の反応性を評価するために使用される。目標指向型輸液療法(goal-directed fluid therapy:GDFT)は、現代のGDT概念の最初であり、最も一般的に知られている、輸液の繰り返しである。高度な血行力学モニターは、前負荷依存性を特定し、フランク・スターリング曲線上の患者の位置を最適化するために、輸液のボーラス投与によって治療の決定を支援し、輸液反応性を評価するために使用される。7,17 輸液管理に関する2020 Perioperative Quality Initiative (POQI)のコンセンサスステートメントは、輸液療法のガイドのための最も安全で効果的な方法は輸液反応性を評価することであると断言した。7 さらに、輸液によるSVの最適化は、腸管灌流の改善と合併症の減少につながり、適切な循環血液量と腸管灌流の重要性を示唆している。36 GDTのもう1つの要素である目標志向型循環管理(Goal-directed hemodynamic therapy, GDHT)は、IOHを回避するためのMAPの維持をプロトコルに組み込むことで、元のGDFT戦略を改善した。17 血行動態の最適化を組み込んだGDT戦略は、合併症と死亡率の大幅な減少に関連している。5,11,32 図1は、GDFTの初期の輸液の繰り返しのコンポーネント、次に灌流全体を取り込んでいるGDHTを網羅した、最新のGDT概念を示している。
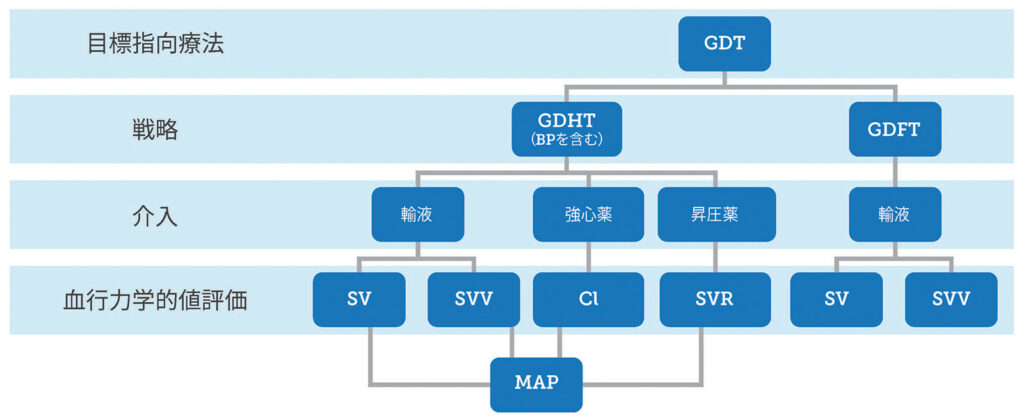
図1:GDHT戦略とGDFT戦略を概念的に統合した結果として得られるGDT戦略の構成要素と、特定の目標に向かった介入を導く血行動態値の図。
GDT:Goal-directed therapy (目標指向療法); GDHT:Goal-directed hemodynamic therapy (目標志向型循環管理); GDFT:Goal-directed fluid therapy (目標指向型輸液療法); SV:Stroke volume (一回拍出量);
SVV:Stroke volume variation (一回拍出量変動; CI:Cardiac index (心係数); SVR:Systemic vascular resistance (末梢血管抵抗); MAP:Mean arterial pressure (平均動脈圧)
IOHの原因に応じた適切な治療法を決定し、血行力学を最適化することを目的としたGDTプロトコルによる高度な血行力学モニタリングを使用した複数の研究では、術後合併症の大幅な減少が示されている。5,11,24,32 FEDORA試験は、GDHTプロトコルを使用すると、低リスクから中リスクの手術患者の合併症と入院期間(length of stay, LOS)が減少することを明らかとした画期的な研究である。5 別の研究では大手術を受ける高リスク患者にGDHTプロトコルを使用した。この試験の結果、術後の臓器機能不全のリスクが減少した。32 後者の研究の強みの1つは、一回拍出量の最適化のため輸液投与を調整し、それによって血管内容量と臓器灌流圧を維持し低灌流から保護するために使用されるプロトコル化された血行力学アルゴリズムである。脊椎手術を受ける高齢患者を対象とした研究では、GDTプロトコルの使用は、対照群と比較してGDT群でIOH、術後の悪心と嘔吐、せん妄が減少した。11 さらに、GDTプロトコルを使用した他の研究ではIOHの減少が報告されており、IOHの原因を標的にすることを目的としたケアの指針となるプロトコルの使用がさらに支持されている。21,23,24 GDT は、低リスク、中等度、高リスクの患者を含むさまざまな患者に利益をもたらすことが示されている。
IOH は深刻な公衆衛生問題である
IOHと有害転帰の関連に関する 2021 年の論文では、IOHは、いかなる年齢層であっても、いかなる時代においても許容されるものではない「重大な公衆衛生問題」と述べられている。1 IOH曝露のリスクにさらされている人口の規模を考慮して、著者らはIOH予防に焦点を当てたさらなる研究が早急に必要だとした。従来の血行力学管理は、IOHが発生した後に事後対応的に治療することに頼っているが、すでに臓器障害を引き起こしているため、これでは手遅れである。20 2021年のAPSF ニュースレターの記事で、Sesslerは人工知能と機械学習に基づいた最近の技術進歩によるIOHの予測の利点について言及した。37 その後、IOHを正確に予測し減少させるための新しい技術の使用を検証する多くの研究が発表された。8,20-23,26 切迫したIOHの可能性とその根本原因を予測するために利用可能な技術の1つは、低血圧予測指数(hypotension prediction index, HPI)と呼ばれるパラメーターの利用である。HPIは、低血圧イベントが発生する確率を示す0から100までの単位のない数値を提供する。38 モニターから提供される差し迫ったIOHの根本的な原因に関する情報を使用することで、臨床医は目標を絞った治療で適切に介入でき、IOHを回避できる。HPIのIOH低減能力を評価したランダム化対照試験の体系的レビューの中で、著者らはHPIには非心臓手術中のIOHの発生、期間、重症度を軽減する可能性があると述べたが、HPIを使用する際にはプロトコルに基づいた管理の遵守の重要性を強調した。22 この知見は、IOH発生率を減らす上で、実践のばらつきを減らすことの役割をさらに裏付けるものである。
麻酔専門家は、患者に優れた麻酔ケアを提供するよう努めているが、血行力学管理が潜在的に有害な結果をもたらすことに気づいていない可能性がある。Gregoryらが力説しているように、IOHは「公共の安全上の問題」であり、最小限に抑える必要がある。1 段階的アプローチがこの目標を達成するのに役立つかもしれない。図2は、APSFから最近公開されたコンセンサス推奨事項とベストプラクティスを組み込んだ、この記事の著者が提案する次のステップを示している。39
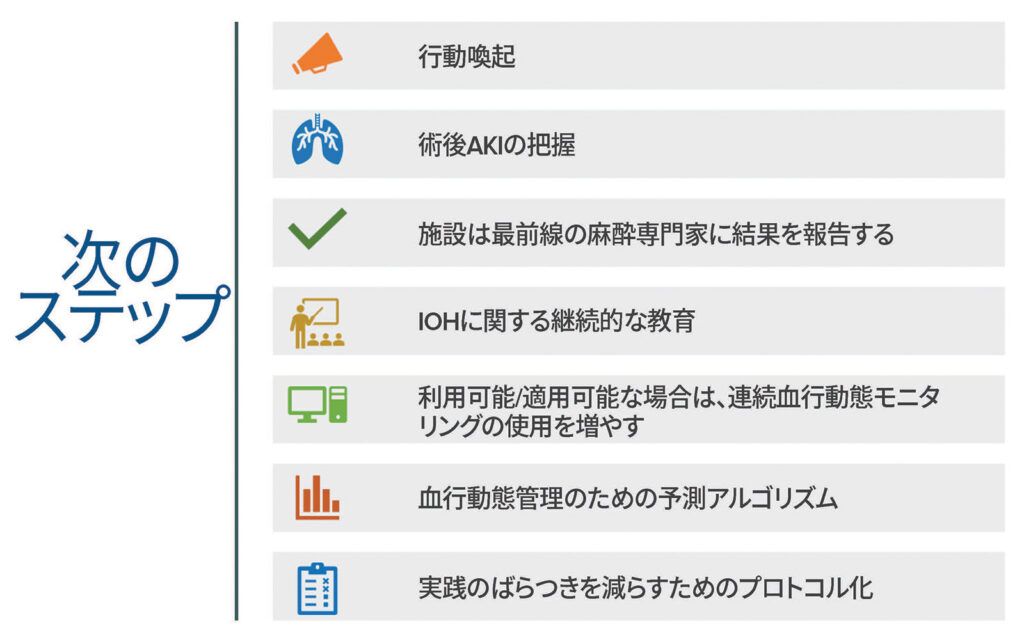
図2. 麻酔専門家に提案される次のステップ。 この図には、IOHとそれに伴う患者への害を最小限に抑えるという目標の達成に役立つ、APSFから最近発表されたコンセンサス推奨事項とベストプラクティスが組み込まれている。39
AKI: acute kidney injury; IOH: intraoperative hypotension
IOHが一般的な問題であることを認識し、教育を通じて、また非心臓手術後AKIや心筋障害などの術後転帰を監視し追跡することによって、同僚の意識を高める必要がある。検出されないIOHを回避するためには、高度な血行力学技術を使用して連続的に監視する必要がある。モニター上の数値を昇圧薬で処理するのではなく、循環のバランスをとって問題を修正することで血行動態を適切に管理する必要がある(GDTプロトコルなど)。IOHは改善可能なリスクであり、容認し続けるべきではない。
Amy Yerdon, DNP, MNA, CRNA, CNE, CHSEは、University of Alabama at Birmingham School of Nursingの助教授(日本の講師・助教に相当)であり、アラバマ州Nurse Anesthesia Programのアシスタントプログラムディレクターである。
Matthew Sherrer, MD, MBA, FASA, FAACDは、アラバマ州バーミンガムUniversity of Alabama at BirminghamのDepartment of Anesthesiology and Perioperative Medicineの准教授である。
Desiree Chappell, MSNA, CRNA, FAANAは、ケンタッキー州ルイビルにあるNorthstar Anesthesia臨床品質担当副社長である。
Amy Yerdon, DNP, MNA, CRNAは、Edwards Lifesciencesの講演者局のメンバーである。D. Matthew Sherrer, MD, MBA, FASA, FAACDに開示すべき利益相反はない。Desiree Chappell, MSNA, CRNA, FAANAは、TopMedTalkの編集長兼リードアンカーであり、Edwards Lifesciences and Medtronicの講演者局のメンバーであり、プロベーション諮問委員会のメンバーでもある。
参考文献
- Gregory A, Stapelfeldt W, Khanna A, et al. Intraoperative hypotension is associated with adverse clinical outcomes after noncardiac surgery. Anesth Analg. 2021 ;132:1654–1665. PMID: 33177322.
- Salmasi V, Maheshwari K, Yang D, et al. Relationship between intraoperative hypotension, defined by either reduction from baseline or absolute thresholds, and acute kidney and myocardial injury after noncardiac surgery: a retrospective cohort analysis. Anesthesiology. 2017;126:47–65. PMID: 27792044.
- Wesselink E, Kappen T, Torn H, et al. Intraoperative hypotension and the risk of postoperative adverse outcomes: a systematic review. Br J Anaesth. 2018;121:706–721. PMID: 30236233.
- Stapelfeldt WH, Khanna AK, Shaw AD, et al. Association of perioperative hypotension with subsequent greater healthcare resource utilization. J Clin Anesth. 2021;75. PMID: 34536719.
- Calvo-Vecino JM, Ripollés-Melchor J, Mythen MG, et al. Effect of goal-directed haemodynamic therapy on postoperative complications in low–moderate risk surgical patients: a multicentre randomized controlled trial (FEDORA trial). Br J Anaesth. 2018;120:734–744.
- Chiu C, Fong N, Lazzaresch, D, et al. Fluids, vasopressors, and acute kidney injury after major abdominal surgery between 2015 and 2019: A multicentre retrospective analysis. Br J Anaesth. 2022;12:317–326. PMID: 29576114.
- Martin GS, Kaufman DA, Marik PE, et al. Perioperative Quality Initiative (POQI) consensus statement on fundamental concepts in perioperative fluid management: fluid responsiveness and venous capacitance. Perioper Med (Lond). 2020;9:1–12. PMID: 32337020.
- Ranucci M, Barile L, Ambrogi F, Pistuddi V. Surgical and Clinical Outcome Research (SCORE) Group. Discrimination and calibration properties of the hypotension probability indicator during cardiac and vascular surgery. Minerva Anestesiol. 2019;85:724–730. PMID: 30481996.
- Putowski Z, Czajka S, Krzych ŁJ. Association between intraoperative BP drop and clinically significant hypoperfusion in abdominal surgery: a cohort study. J Clin Med. 2021;10(21):5010. PMID: 34768530.
- Maheshwari K, Ahuja S, Khanna AK, et al. Association between perioperative hypotension and delirium in postoperative critically ill patients: a retrospective cohort analysis. Anesth Analg. 2020;130:636–643. PMID: 31725024.
- Zhang N, Liang M, Zhang D, et al. Effect of goal-directed fluid therapy on early cognitive function in elderly patients with spinal stenosis: a case-control study. Int J Surg. 2018;54:201–205. PMID: 29678619.
- Ariyarathna D, Bhonsle A, Nim J, et al. Intraoperative vasopressor use and early postoperative acute kidney injury in elderly patients undergoing elective noncardiac surgery. Ren Fail. 2022;44:648–659. PMID: 35403562.
- French WB, Shah PR, Fatani YI, et al. Mortality and costs associated with acute kidney injury following major elective, non-cardiac surgery. J Clin Anesth. 2022;82:110933. PMID: 35933842.
- Christensen AL, Jacobs E, Maheshwari K, et al. Development and evaluation of a risk-adjusted measure of intraoperative hypotension in patients having nonemergent, noncardiac surgery. Anesth Analg. 2021;133:445–454. PMID: 33264120.
- Maheshwari K, Khanna S, Bajracharya GR, et al. A randomized trial of continuous noninvasive BP monitoring during noncardiac surgery. Anesth Analg. 2018;127:424–431. PMID: 29916861.
- Park S, Lee HC, Jung CW, et al. Intraoperative arterial pressure variability and postoperative acute kidney injury. Clin J Am Soc Nephrol. 2020;15:35–46. PMID: 31888922.
- French WB, Scott M. Fluid and hemodynamics. Anesthesiol Clin. 2022;40:59–71. PMID: 35236583.
- Kouz K, Brockmann L, Timmermann LM, et al. Endotypes of intraoperative hypotension during major abdominal surgery: a retrospective machine learning analysis of an observational cohort study. Br J Anaesth. 2023;130:253–261. PMID: 36526483.
- Kouz K, Weidemann F, Naebian A, et al. Continuous finger-cuff versus intermittent oscillometric arterial pressure monitoring and hypotension during induction of anesthesia and noncardiac surgery: the DETECT Randomized Trial. Anesthesiology. 2023;139:298–308. PMID: 37265355.
- Frassanito L, Giuri PP, Vassalli F, et al. Hypotension Prediction Index with non-invasive continuous arterial pressure waveforms (ClearSight): clinical performance in gynaecologic oncologic surgery. J Clin Monit Comput. 2022;36:1325–1332. PMID: 34618291.
- Grundmann CD, Wischermann JM, Fassbender P, et al. Hemodynamic monitoring with Hypotension Prediction Index versus arterial waveform analysis alone and incidence of perioperative hypotension. Acta Anaesthesiol Scand. 2021;65:1404–1412. PMID: 34322869.
- Li W, Hu Z, Yuan Y, Liu J, Li K. Effect of hypotension prediction index in the prevention of intraoperative hypotension during noncardiac surgery: a systematic review. J Clin Anesth. 2022;83:110981. PMID: 36242978.
- Schneck E, Schulte D, Habig L, et al. Hypotension Prediction Index based protocolized haemodynamic management reduces the incidence and duration of intraoperative hypotension in primary total hip arthroplasty: a single centre feasibility randomised blinded prospective interventional trial. J Clin Monit Comput. 2020;34:1149–1158. PMID: 31784852.
- Wijnberge M, Geerts BF, Hol L, et al. Effect of a machine learning-derived early warning system for intraoperative hypotension vs standard care on depth and duration of intraoperative hypotension during elective noncardiac surgery: the HYPE randomized clinical trial. JAMA. 2020;323:1052–1060. PMID: 32065827.
- Wijnberge M, van der Ster B, Vlaar APJ, et al. The effect of intermittent versus continuous non-invasive BP monitoring on the detection of intraoperative hypotension, a sub-study. J Clin Med. 2022;11:4083. PMID: 35887844.
- Kouz K, Monge García MI, Cercutti E, et al. Intraoperative hypotension when using hypotension prediction index software during major noncardiac surgery: a European multicentre prospective observational registry (EU HYPROTECT). BJA Open. 2023;6:100140. PMID: 37588176.
- Shah N, Mentz G, Kheterpal S. The incidence of intraoperative hypotension in moderate to high risk patients undergoing non-cardiac surgery: a retrospective multicenter observational analysis. J Clin Anesth. 2020;66:1–12. PMID: 32663738.
- Provation. ePreop 31: Intraoperative hypotension (IOH) among non-emergent noncardiac surgical cases. 2020. https://www.provationmedical.com/wp-content/uploads/2022/08/ePreop-Provation_IOH_Specifications.pdf . Accessed March 2024.
- U.S. Centers for Medicare & Medicaid Services (CMS). Traditional MIPS overview. CMS Quality Payment Program. https://qpp.cms.gov/mips/traditional-mips. Accessed January 3, 3024.
- Saasouh W, Christensen AL, Xing F, et al. Incidence of intraoperative hypotension during non-cardiac surgery in community anesthesia practice: a retrospective observational analysis. Perioper Med (Lond). 2023;12:29. Published 2023 Jun 24. PMID: 37355641.
- Anolik RA, Sharif-Askary B, Hompe E, et al. Occurrence of symptomatic hypotension in patients undergoing breast free flaps: is enhanced recovery after surgery to blame? Plast Reconstr Surg. 2020;145:606–616. PMID: 32097291.
- Futier E, Lefrant JY, Guinot PG, et al. Effect of individualized vs standard BP management strategies on postoperative organ dysfunction among high-risk patients undergoing major surgery. JAMA. 2017;318:1346. PMID: 28973220.
- Meidert AS, Nold JS, Hornung R, et al. The impact of continuous non-invasive arterial BP monitoring on BP stability during general anaesthesia in orthopaedic patients: a randomised trial. Eur J Anaesthesiol. 2017;34:716–722. PMID: 28922340.
- Klose P, Lorenzen U, Berndt R, et al. Continuous noninvasive monitoring of arterial pressure using the vascular unloading technique in comparison to the invasive gold standard in elderly comorbid patients: a prospective observational study. Health Sci Rep. 2020;3:e204. PMID: 33204849.
- Maheshwari K, Buddi S, Jian Z, et al. Performance of the Hypotension Prediction Index with non-invasive arterial pressure waveforms in non-cardiac surgical patients. J Clin Monit Comput. 2021;35:71–78. PMID: 31989416.
- Davies SJ, Mythen M. Hemodynamic and intestinal microcirculatory changes in a phenylephrine corrected porcine model of hemorrhage. Anesth Analg. 2021;133:1060–1069. PMID: 33755645.
- Sessler D. Perioperative hypotension. APSF Newsletter. 2021;36:89–94. https://www.apsf.org/article/perioperative-hypotension/ . Accessed March 2024.
- Edwards Lifesciences. Acumen IQ sensor: minimally-invasive predictive decision support. https://www.edwards.com/healthcare-professionals/products-services/predictive-monitoring/acumen-iq-sensor. Accessed March 27, 2023.
- Scott MJ, and the APSF Hemodynamic Instability Writing Group. Perioperative patients with hemodynamic instability: consensus recommendations of the Anesthesia Patient Safety Foundation. Anesth Analg. 2024;138:713–724. PMID: 38153876.


 Issue PDF
Issue PDF