 마취과 의료진은 환자 안전 분야에서 지속적으로 선도적인 역할을 해왔으며, 마취 영역에서 손 위생의 중요성을 오랫동안 인식해 왔습니다.1 손 오염은 마취 영역 내 여러 감염원 간 병원균 전파와 관련이 있으며, 의료진 손에서 배양된 세균과 감염을 유발하는 병원균의 유전체 분석을 통해 의료진이 환자 감염을 초래하는 병원균을 전파한다는 사실이 확인되었습니다.2,3,4 황색포도상구균(Staphylococcus aureus, S. aureus)의 마취 영역 내 감염원 간 전파는 수술 부위 감염(SSI)의 위험 증가와 관련이 있습니다.5 실제로, 수술 부위 감염 위험은 예방적 항생제에 감수성을 보이는 병원균이 존재할 경우 5배 이상 증가하며, 예방적 항생제에 내성을 가진 병원균이 존재할 경우 9배 이상 증가합니다.6 이러한 위험을 줄이기 위해서는 수술 부위 감염 예방을 위한 다각적인 접근법이 필요합니다.7 손 위생 개선이 포함된 다각적 프로그램을 시행할 경우, 황색포도상구균 전파 및 수술 부위 감염 발생률을 상당히 감소시킬 수 있습니다.8,9 이러한 연구 결과는 모든 수술실 의료진이 손 위생 준수를 강화하는 데 있어 중요한 근거가 되며, 특히 마취과 의료진이 선도적인 역할을 수행해야 합니다.
마취과 의료진은 환자 안전 분야에서 지속적으로 선도적인 역할을 해왔으며, 마취 영역에서 손 위생의 중요성을 오랫동안 인식해 왔습니다.1 손 오염은 마취 영역 내 여러 감염원 간 병원균 전파와 관련이 있으며, 의료진 손에서 배양된 세균과 감염을 유발하는 병원균의 유전체 분석을 통해 의료진이 환자 감염을 초래하는 병원균을 전파한다는 사실이 확인되었습니다.2,3,4 황색포도상구균(Staphylococcus aureus, S. aureus)의 마취 영역 내 감염원 간 전파는 수술 부위 감염(SSI)의 위험 증가와 관련이 있습니다.5 실제로, 수술 부위 감염 위험은 예방적 항생제에 감수성을 보이는 병원균이 존재할 경우 5배 이상 증가하며, 예방적 항생제에 내성을 가진 병원균이 존재할 경우 9배 이상 증가합니다.6 이러한 위험을 줄이기 위해서는 수술 부위 감염 예방을 위한 다각적인 접근법이 필요합니다.7 손 위생 개선이 포함된 다각적 프로그램을 시행할 경우, 황색포도상구균 전파 및 수술 부위 감염 발생률을 상당히 감소시킬 수 있습니다.8,9 이러한 연구 결과는 모든 수술실 의료진이 손 위생 준수를 강화하는 데 있어 중요한 근거가 되며, 특히 마취과 의료진이 선도적인 역할을 수행해야 합니다.
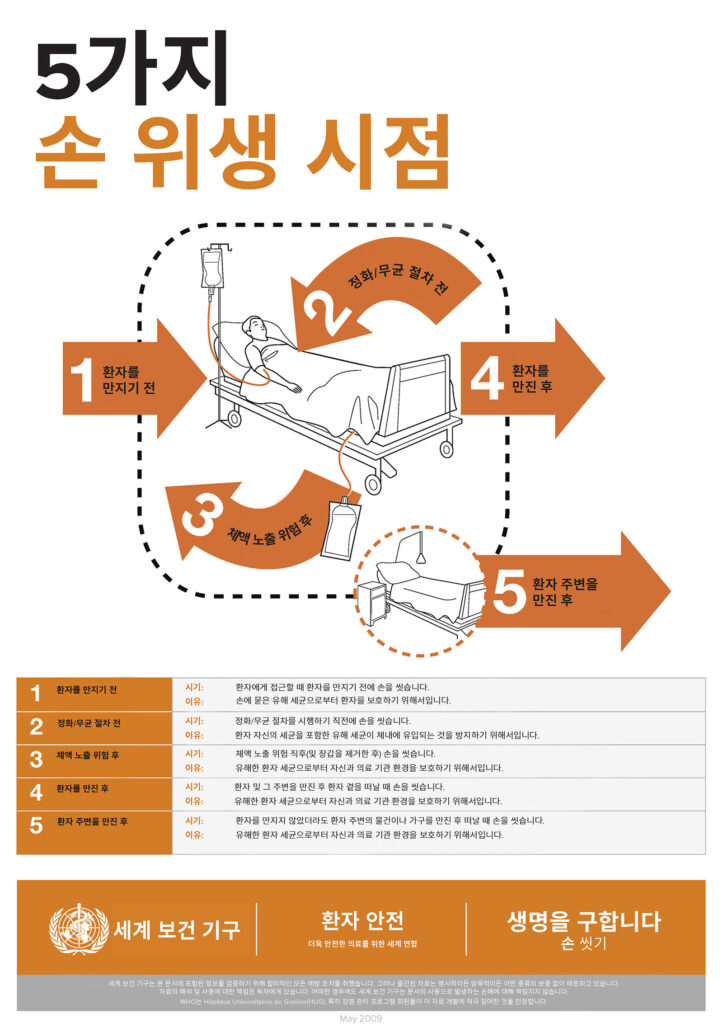
마취 영역은 환자, 수술대/테이블, 마취기, 주입 장치가 부착된 정맥 주입(IV) 폴대, 깨끗한 물품이 보관된 카트, 그리고 카트 내 또는 별도의 약제 보관소에 저장된 약물 등을 포함하는 복잡한 환경입니다. 마취과 의료진은 일상적인 마취 과정에서 환자뿐만 아니라 마취 영역 내 여러 구성 요소와 지속적으로 상호작용하게 됩니다.10,11 이러한 환경의 복잡성을 고려할 때, 손 소독은 병원균 전파를 차단하고 감염 확산을 줄이기 위해 필수적입니다. 세계 보건 기구(WHO)는 손 위생을 시행해야 하는 시점을 “5가지 손 위생 시점”으로 정의하고 있습니다.12 손 위생이 필요한 시점은 환자를 접촉하기 전, 깨끗한 또는 무균적 시술 전, 환자를 접촉한 후, 체액 노출 위험이 있는 처치 후, 환자의 주변 환경을 접촉한 후 입니다(그림 1).12 세계보건기구 및 유사한 권고안을 준수하려면 마취과 의료진은 시간당 54회13에서 최대 150회까지 손 위생을 시행해야 합니다.11,13 그러나 연구에 따르면 마취과 의료진의 손 위생 시행 횟수는 시간당 1회 미만으로 나타났으며,14 이는 손 위생 개선의 여지가 상당히 크다는 것을 의미합니다. 세균이 환경 전반에 널리 퍼져 있다는 점에서 병원균 전파를 완전히 차단하는 것이 불가능해 보일 수도 있습니다. 그러나 연구에 따르면 의료진의 손에서 황색포도상구균 수치를 100 콜로니 형성 단위 (CFU) 미만으로 줄이는 것은 현실적으로 가능한 목표이며, 이를 통해 환자를 보호할 수 있습니다.9,15
APSF 환자안전 우선순위 옹호 단체: 감염병 전문가들은 마취과 의료진이 마취 관리 중 최소한 시간당 8회 이상 손 위생을 수행할 것을 권장하고 있습니다.16 손을 씻거나 손 소독제를 시간당 8회 사용하는 것이 환경 오염 및 스톱콕 (stopcock) 오염을 최적화하여 감염 발생을 감소시키는 것으로 나타났습니다.14 그러나 이러한 빈도로 손 위생을 준수를 유도할 적절한 방법은 명확하지 않습니다.16 향후 연구에서 고려해야 할 중요한 요소로는 손 위생 제품(예: 알코올 기반 소독제 또는 비누와 물), 소독제 디스펜서의 위치, 세정 기술, 잠재적 위험 등이 포함됩니다.
알코올 기반 용액을 사용해 손의 오염을 효과적으로 제거할 수 있지만, 눈에 띄게 오염된 손이나 포자 형성 유기체와의 접촉 후에는 비누와 물로 오염을 제거해야 합니다.14,17 스크럽 싱크대는 수술실 밖에 있어야 하므로 알코올은 마취과 의료진의 기본 손 위생 옵션입니다. 또한 알코올은 비누와 물보다 피부 자극이 적기 때문에 피부 자극 위험과 자극받은 피부에서의 세균 수를 줄일 수 있습니다.18,19
소독제 디스펜서 위치는 일정 기간에 수행해야 하는 작업 수를 나타내는 작업 밀도에 따라 결정해야 합니다. 의료 감염 예방 기관들은 환자 치료 영역 내에서 쉽게 접근할 수 있는 위치에 소독제 디스펜서를 배치하도록 권장합니다.20 마취 영역 외부(예: 벽이나 수술실 입구 근처)에 소독제 디스펜서를 배치하는 것은 환자 치료에 방해가 될 수 있습니다. 작업 밀도의 중요성은 잘 설명되어 있습니다. 한 연구에서 마취과 의료진이 몸에 착용하는 개별 알코올 디스펜서를 사용했을 때 손 위생 준수율이 37배 증가했으며, 결과적으로 환경 오염 및 스톱콕 오염, 그리고 의료 관련 감염 발생률을 감소시켰습니다.14 다른 연구자들은 다각적 프로그램의 일환으로 의료 제공자의 왼쪽에 있는 정맥 주입 폴에 디스펜서를 배치하는 방법을 평가했습니다.8,9 이 위치에 디스펜서를 배치하자 세균 전파 및 이후 수술 부위 감염 발생률이 감소했습니다.8,9
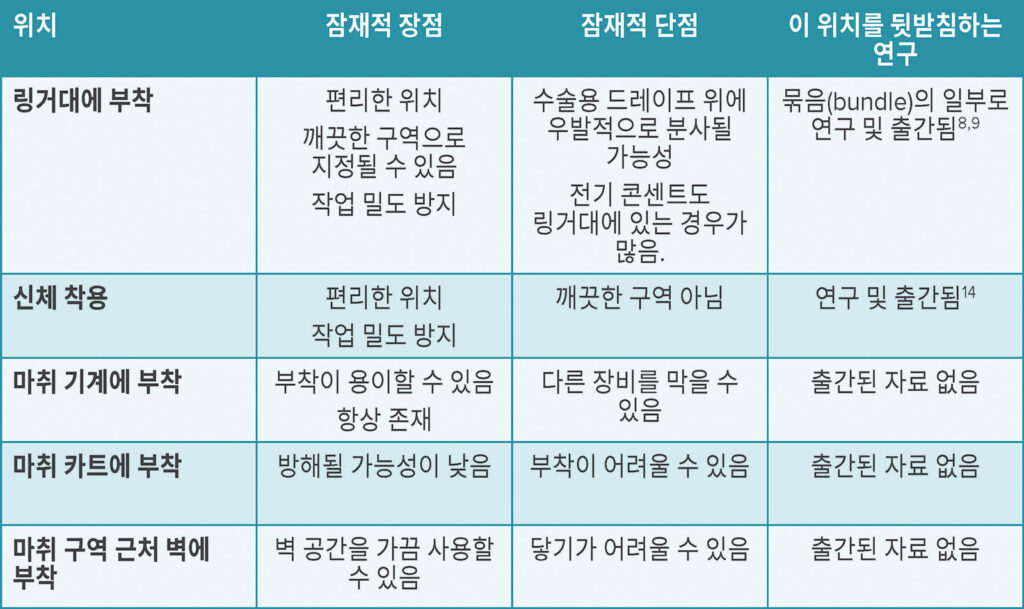
의료 제공자의 손 오염은 주변 오염과 연관이 있으므로, 주변 청소의 빈도와 질을 개선해 손 위생 개선 노력에 도움이 될 수 있습니다. 한 연구에서는 마취 작업 영역을 “청결한” 구역과 “오염된” 구역으로 분리했을 때 100 콜로니 형성 단위(CFU)를 초과하는 구역의 비율이 감소했습니다.14,21 알코올 디스펜서는 청결한 구역으로 지정된 곳에 배치하는 것이 직관적입니다. 예를 들어 디스펜서는 마취기나 공급 카트에 장착 랙을 사용하여 고정하거나, 정맥 주입 폴에 배치할 수 있습니다. 정맥 주입 폴에 고정할 경우, 환자, 수술 부위, 그리고 전기 플러그가 튀거나 떨어지는 액체로부터 보호될 수 있도록 주의해야 합니다(표 1).
표 1: 마취 시설의 손 세정제 위치에 대한 잠재적 고려 사항.
마취과 의료진은 손 소독제에 쉽게 접근할 수 있어야 하지만, 고려해야 할 잠재적인 위험이 존재합니다. 모든 알코올 기반 세정제에는 60~80% 에틸 또는 이소프로필 알코올과 물이 함유되어 있습니다. 이는 미생물 세포막을 가수 분해하고 제품의 증발을 늦추기 위해 충분한 수분 성분이 필요하기 때문입니다.22,23 알코올 제품은 인화성이므로, 화재 규정은 수술실 내에서 허용되는 세정제의 총량과 알코올 디스펜서 간 최소 거리를 규제합니다. 디스펜서는 최소 4피트(약 1.2m) 간격으로 배치해야 하며, 한 방 안에 배치된 손 세정제의 총 용량은 1.2리터를 초과할 수 없습니다.24 질병 통제 예방 센터(Centers for Disease Control and Prevention) 역시 이러한 화재 안전 권고안을 지지합니다.25 몸에 착용하는 개별 알코올 디스펜서와 정맥 주입 폴에 장착된 한 손으로 조작 가능한 알코올 펌프 용량은 3온스 (약 85ml) 미만입니다.8,9,14 손 세정제와 관련된 화재에 대한 보고는 없지만, 이는 고려해야 할 위험 요소입니다.
요약하자면, 마취과 의료진의 손 위생 개선은 세균 전파 및 감염 발생을 줄이기 위한 다각적 접근의 중요한 요소입니다. 일상적인 마취 관리 중 시간당 8회 손 위생을 시행하도록 장려해야 합니다. 마취 영역 내 알코올 기반 세정제는 청결하고 쉽게 접근할 수 있는 위치에 배치되어야 하며, 이는 의료진이 명확히 시각적으로 확인할 수 있어야 합니다.
Jonathan E. Charnin(MD, FASA)은 미네소타주 로체스터 메이오 클리닉의 마취 및 수술전후 의학과 마취 조교수입니다.
Brendan T. Wanta(MD)는 미네소타주 로체스터 메이오 클리닉의 마취 및 수술전후 의학과 마취 조교수입니다.
Richard A. Beers(MD)는 뉴욕주 시러큐스 뉴욕 주립대학교 업스테이트 의과대학의 명예 교수입니다.
Jonathan M. Tan(MD, MPH, MBI, FASA)은 캘리포니아주 로스앤젤레스의 로스앤젤레스 아동병원 및 서던캘리포니아 대학교 마취 중환자 의학과 임상 마취학 및 공간 과학 조교수, 분석 및 임상 효능 부위원장입니다.
Michelle Beam(DO, MBA, FASA, FACHE)은 펜실베이니아주 웨스트체스터 Penn Medicine 웨스트체스터 마취 전문의입니다.
Sara McMannus(RN, BSN, MBA)는 패혈증 연대의 임상 고문입니다.
Desiree Chappell(MSNA, CRNA)는 텍사스주 어빙 NorthStar Anesthesia 임상 품질 부사장입니다.
Randy W. Loftus(MD)는 미네소타주 로체스터 메이오 클리닉의 마취 및 수술전후 의학과 마취 부교수입니다.
Jonathan Tan은 마취환자안전재단(Anesthesia Patient Safety Foundation), 마취교육연구재단(Foundation for Anesthesia Education and Research), 서던 캘리포니아 환경 의료과학 센터(Southern California Environmental Health Sciences Center)에서 연구 보조금을 받고 있습니다. 그는 GE HealthCare 및 Edwards LifeSciences의 컨설턴트입니다.
Desiree Chappell은 Medtronic 및 Edwards Life Sciences의 연사국과 ProVation 자문위원회에 소속되어 있습니다.
Randy Loftus는 NIH R01 AI155752-01A1, “BASIC trial: Improving implementation of evidence-based approaches and surveillance to prevent bacterial transmission and infection”으로 현 연구 자금을 보고하고 마취환자안전재단, Sage Medical Inc., BBraun, Dräger, Surfacide, Kenall에서 자금을 받았습니다. 하나 이상의 특허를 보유하고 있으며 OR PathTrac을 보유한 RDB Bioinformatics, LLC의 파트너이며 Kenall과 Bbraun이 후원하는 교육 회의에서 연설했습니다.
저자들은 이해관계 상충이 없습니다.
참고 문헌
- Warner MA, Warner ME. The evolution of the anesthesia patient safety movement in America: lessons learned and considerations to promote further improvement in patient safety. Anesthesiology. 2021;135:963–974. PMID: 34666350
- Dexter F, Loftus RW. Estimation of the contribution to intraoperative pathogen transmission from bacterial contamination of patient nose, patient groin and axilla, anesthesia practitioners’ hands, anesthesia machine, and intravenous lumen. J Clin Anesth. 2024;92:111303. Epub 2023 Oct 22. PMID: 37875062.
- Loftus RW, Brindeiro CT, Loftus CP, et al. Characterizing the molecular epidemiology of anaesthesia work area transmission of Staphylococcus aureus sequence type 5. J Hosp Infect. 2024;143:186–194. Epub 2023 Jul 13. PMID: 37451409.
- Loftus RW, Brown JR, Koff MD, et al. Multiple reservoirs contribute to intraoperative bacterial transmission. Anesth Analg. 2012;114:1236–1248. Epub 2012 Mar 30. PMID: 22467892.
- Hopf, Harriet W. MD. Bacterial reservoirs in the operating room. Anesthesia & Analgesia. 2015;120:p 700–702. PMID: 25790198
- Loftus RW, Dexter F, Brown JR. Transmission of Staphylococcus aureus in the anaesthesia work area has greater risk of association with development of surgical site infection when resistant to the prophylactic antibiotic administered for surgery. J Hosp Infect. 2023;134:121–128. doi: 10.1016/j.jhin.2023.01.007. Epub 2023 Jan 21. PMID: 36693592.
- Dexter F, Brown JR, Wall RT, Loftus RW. The efficacy of multifaceted versus single anesthesia work area infection control measures and the importance of surgical site infection follow-up duration. J Clin Anesth. 2023;85:111043. Epub 2022 Dec 23. PMID: 36566648.
- Loftus RW, Dexter F, Goodheart MJ, et al. The effect of improving basic preventive measures in the perioperative arena on Staphylococcus aureus transmission and surgical site infections: a randomized clinical trial. JAMA Netw Open. 2020;3: e201934. PMID: 32219407
- Wall RT, Datta S, Dexter F, et al. Effectiveness and feasibility of an evidence-based intraoperative infection control program targeting improved basic measures: a post-implementation prospective case-cohort study. J Clin Anesth. 2022; 77:110632. Epub 2021 Dec 17. PMID: 34929497.
- Sharma A, Fernandez PG, Rowlands JP, et al. Perioperative infection transmission: the role of the anesthesia provider in infection control and healthcare-associated infections. Curr Anesthesiol Rep. 2020;10:233–241. Epub 2020 Jul 17. PMID: 32837343
- Rowlands J, Yeager MP, Beach M, et al. Video observation to map hand contact and bacterial transmission in operating rooms. Am J Infect Control. 2014;42:698–701. PMID: 24969122
- WHO guidelines on hand hygiene in health care: first global patient safety challenge clean care is safer care. Geneva: World Health Organization; 2009. 21, The WHO Multimodal Hand Hygiene Improvement Strategy. Available from: https://www.who.int/publications/i/item/9789241597906. Accessed July 5, 2024
- Biddle C, Shah J. Quantification of anesthesia providers’ hand hygiene in a busy metropolitan operating room: what would Semmelweis think? Am J Infect Control. 2012;40:756–759. Epub 2012 Feb 9. PMID: 22325482.
- Koff MD, Loftus RW, Burchman CC, et al. Reduction in intraoperative bacterial contamination of peripheral intravenous tubing through the use of a novel device. Anesthesiology. 2009;110:978–985. PMID: 19352154.
- Dexter F, Walker KM, Brindeiro CT, et al. A threshold of 100 or more colony-forming units on the anesthesia machine predicts bacterial pathogen detection: a retrospective laboratory-based analysis. Can J Anaesth. 2024;71:600–610. English. Epub 2024 Feb 27. PMID: 38413516.
- Charnin JE, Hollidge M, Bartz R, et al. A best practice for anesthesia work area infection control measures: what are you waiting for? APSF Newsletter. 2022;37:103-106. https://www.apsf.org/article/a-best-practice-for-anesthesia-
work-area-infection-control-measures-what-are-you-waiting-for/ Accessed August 9, 2024. - WHO guidelines on hand hygiene in health care: first global patient safety challenge clean care is safer care. Appendix 2. Guide to appropriate hand hygiene in connection with Clostridium difficile spread. https://www.ncbi.nlm.nih.gov/books/NBK144042/. Accessed May 29, 2024.
- Pedersen LK, Held E, Johansen JD, Agner T. Short-term effects of alcohol-based disinfectant and detergent on skin irritation. Contact Dermatitis. 2005;52:82–87. PMID: 15725285
- Larson EL, Hughes CA, Pyrek JD, et al. Changes in bacterial flora associated with skin damage on hands of health care personnel. Am J Infect Control. 1998;26:513–521. PMID: 9795681
- Glowicz JB, Landon E, Sickbert-Bennett EE, et al SHEA/IDSA/APIC practice recommendation: strategies to prevent healthcare-associated infections through hand hygiene: 2022 update. Infect Control Hosp Epidemiol. 2023;44:355–376. PMID: 36751708
- Clark C, Taenzer A, Charette K, Whitty M. Decreasing contamination of the anesthesia environment. Am J Infect Control. 2014 Nov;42(11):1223-5. Epub 2014 Oct 30. PMID: 25444268.
- Ali Y, Dolan MJ, Fendler EJ, Larson EL. Alcohols. In: Block SS, ed. Disinfection, sterilization, and preservation. Philadelphia: Lippincott Williams & Wilkins, 2001:229–254.
- Rutala WA, Weber DJ, and the Healthcare Infection Control Practices Advisory Committee. Guideline for disinfection and sterilization in healthcare facilities, 2008. https://stacks.cdc.gov/view/cdc/47378 Accessed August 9, 2024.
- National Fire Protection Association (NFPA). NFPA 101 Life Safety Code. 2018 edition. Quincy, MA: National Fire Protection Association; 2018. https://www.nfpa.org/codes-and-standards/all-codes-and-standards/list-of-codes-
and-standards/detail?code=101 Accessed August 9, 2024. - Centers for Disease Control and Prevention (CDC). Clinical safety: hand hygiene for healthcare workers – fire safety and Alcohol-Based Hand Sanitizer (ABHS). https://www.cdc.gov/clean-hands/hcp/clinical-safety/?CDC_AAref_Val=https://www.cdc.gov/handhygiene/firesafety/index.htm Accessed July 5, 2024.


 Issue PDF
Issue PDF