이 기사는 최근 악성 고열(MH) 사례에 대해 논의하고, 마취 전문의가 수술실 밖에서도 환자 관리를 개선할 방법을 설명합니다. “MH 관리의 4C”라는 개념을 소개합니다.
서론
마취 전문가로서 악성 고열(MH)이 갑자기 발생하여 빠르게 근경직, 이상 고열, 호기말 CO2 상승, 호흡기 및 대사성산증을 유발할 수 있으며, 신속하고 구체적으로 치료하지 않으면 사망에 이를 수 있다는 것을 알고 계실 것입니다. 또한 MH는 상염색체 우성 방식으로 유전되긴 하지만, 남성이 여성보다 발생률이 더 높으며 어린이가 성인보다 더 자주 발생하는 경향이 있다는 점도 알고 계실 것입니다.1
여기서는 최근 발생한 MH 사례를 소개하고, 마취 전문의들이 MH에 대한 이해를 넓히는데 기여한 역사적 관점을 제시하며, 향후 급성 에피소드 이후에도 환자 치료에서 중요한 역할을 수행할 수 있는 방향에 대해 논의합니다. 이는 후속 증상의 적절한 진단과 이해를 보장하기 위한 과정입니다.
MH 사례
건강한 11세 여아가 우연히 발견된 난소성 기형종을 복강경 수술로 제거하기 위해 병원에 내원했습니다. 이전에 수술이나 마취 경험은 없었습니다. 세보플루란 마취 유도, 로큐로니움 마비, 삽관 직후 지속적인 빈맥(80초 기준에서 심박수 120bpm)이 발생했고 체온이 39.4°C까지 상승했으며 호기말 CO2(ETCO2)가 110mmHg까지 올랐습니다. 비탈분극성 신경근 차단제를 투여한 상태에서도 팔에 근육 경직이 나타났습니다. 이러한 MH 징후가 나타나자마자 위기 관리를 지원할 도움을 요청했습니다. 세보플루란을 중단하고 Ryanodex®(단트롤렌 나트륨, Eagle Pharmaceuticals, Inc.,미국 뉴저지주 우드클리프 레이크)를 신속하게 투여했습니다. 몇 분 안에 심박수와 체온, ETCO2, 근골격계 긴장이 모두 개선되었습니다. 다른 안정화 조치로는 전정맥 마취(TIVA) 시작, 추가 IV 접근 및 동맥 라인 확보, 차가운 수액 투여를 통한 능동적 냉각, 공격적인 수액 공급 등을 시행했습니다. 안정화된 후, 수술을 빠르게 완료했으며 환자를 중환자실로 이송했습니다. 단트롤렌 치료는 계속 진행되었습니다. 특히 환자의 첫 크레아틴키나제(CK) 수치가 34,000IU로 비정상적으로 높았습니다. 환자는 다음 날 삽관된 튜브를 제거했습니다. 이후 며칠 동안 계속해서 개선되었고, 횡문근융해가 해결되었습니다.
이벤트 후 며칠 동안 여러 번 방문한 마취 전문가들은 환자가 이전에 열불내증을 앓은 적이 있으며 환자의 할머니가 만성적으로 CK가 상승한 것을 우연히 발견했지만 근육 생검을 받지 않았다는 사실을 알게 되었습니다. 횡문근융해 및 대사성 근병증과 관련된 129개의 유전자를 검사하는 포괄적인 유전자 패널 검사와 유전학자 및 신경과 의사와의 상담이 진행되었습니다. 유전자 검사 결과, 리아노딘수용체(RYR1)의 변화가 확인되어 MH 진단이 확정되었습니다. 흥미롭게도, 환자는 RYR1 변이를 가진 것으로 확인되었으며, 이는 미국 국립유전체연구소(NHGRI)와 미국의학유전자학회(ACMG)에서 공식적으로 ‘알 수 없는 의의 변이(VUS)’로 분류되지만, 유럽 MH 그룹에서는 병원성 변이로 간주되며, 이전에 CK 수치 상승, 근육 분해증, 근력 약화와 관련이 있었습니다.2 환자는 수술 후 5일째에 퇴원하고 이후 의료 유전학, 신경학, 신경근 클리닉에서 면밀한 추적 관찰을 받게 되었습니다.
MH: 성공 사례
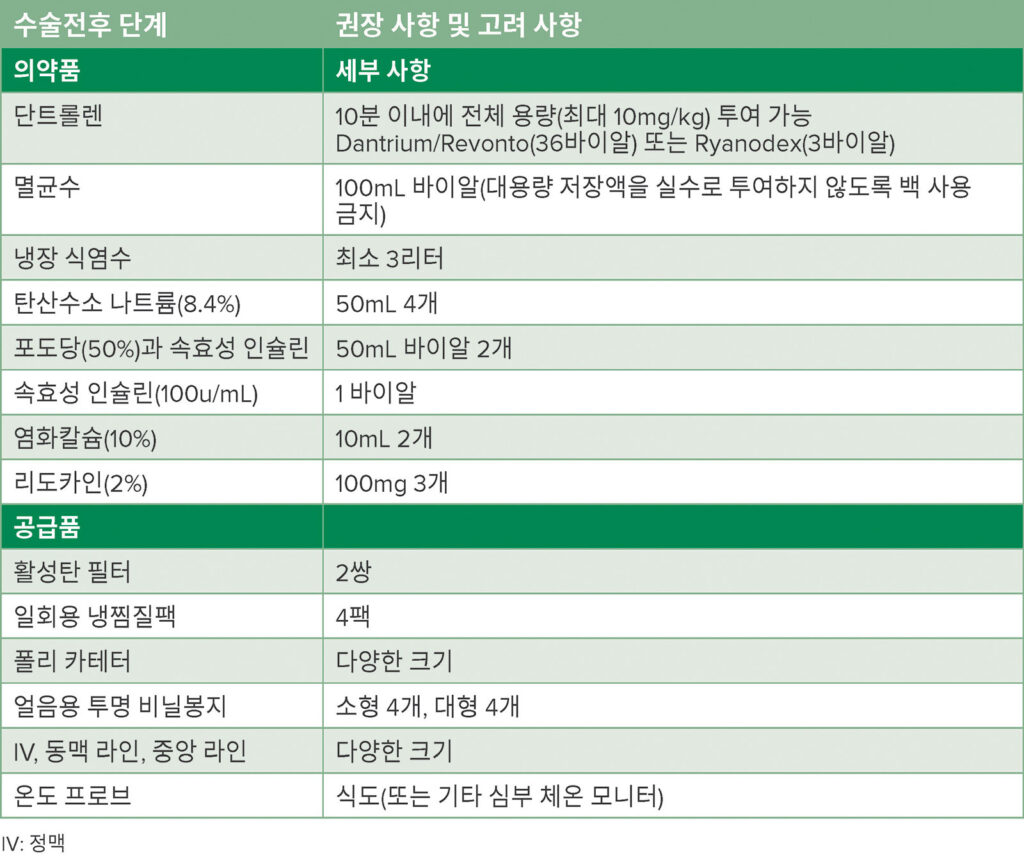
이 환자가 악성 고온증(MH)에 걸리고 성공적으로 진단 및 치료된 사례는 전 세계의 과학자들이 오랜 시간 동안 쌓아온 지식의 결과입니다. 1960년 호주 멜버른에서 Denborough와 Lovell이 처음으로 MH를 설명한 이후, 병리생리학을 정의하고, 효과적인 치료법을 발견하며, MH에 대한 정보를 마취 커뮤니티에 확산시키는 등 많은 발전이 있었습니다.3 결과적으로 단트롤렌 및 기타 공급품(표 1)에 대한 용이한 접근, ICU 관찰을 포함한 진단 및 관리의 조정된 접근 방식, MH를 경험한 사람의 가족과의 에피소드 후 협력 등으로 증후군에 대비한 국가의 MH 사망률이 70%에서 약 10%로 감소했습니다.4
표 1: MH 카트 의약품 및 공급품
향후 방향
많은 과학에서 그렇듯이 한 가지 문제를 해결하면 종종 더 많은 질문들이 생깁니다. 이러한 질문들에 대해 해결하려는 노력에서, 우리는 MH를 일시적이고 특이한 질환으로 보기보다는 약물 유전자질환 및 유전성 근육병으로 보고, 그 결과가 마취 경험과는 거리가 멀 수 있다는 사실을 깨닫게 되었습니다.
첫 번째 질문은 RYR1 변이가 MH 외에 다른 질환에 어떤 영향을 미치는지에 관한 것입니다. RYR1 관련 질환(스타틴 유발성 근병증, 운동성 횡문근융해, 열사병, 만성적으로 상승한 CK 증후군 등)이 MH 감수성(MHS)과 어떤 관련이 있는지를 이해하려면 추가 연구가 필요합니다.5 또한 이러한 다른 증후군 치료에 있어 단트롤렌의 역할과 효능을 이해할 필요가 있습니다.
둘째, 악성 고온증(MH) 에피소드 후, MHS 진단을 어떻게 확인해야 할까요? MHS를 평가하기 위한 유전자 검사에서의 발전은 많은 지역에서 전통적인 근육 생검 카페인 할로탄 수축 검사 대신 유전학이 사실상 대체하게 만들었습니다. 유럽 MH 학회는 2015년 MHS 진단의 1차 검사로 유전학을 사용하도록 권고안을 공식적으로 변경했으며, 전 세계 대부분의 MH 전문가가 이 지침을 따르고 있습니다.6 미국에는 미네소타와 노스캐롤라이나에 위치한 두 센터가 있으며, 검사 비용은 최대 $20,000 USD로 일반적으로 보험회사에서 지불하지 않습니다. 반면 인간 게놈의 첫 번째 염기서열 분석 이후 유전자 검사 비용은 99% 이상 감소했으며 일반적으로 보험 회사에서 보상됩니다. 구체적인 비용은 선택한 검사 유형에 따라 다양합니다. MHS와 관련된 세 가지 유전자(RYR1, CACNA1S, STAC3)의 패널 검사 비용은 $500 USD 미만인 반면,7 좀 더 종합적인 대사 및 근병증 패널 비용은 약 $1,500 USD입니다.8
셋째, MHS 환자들의 에피소드 이후, 마취 전문인은 이들의 치료에서 어떤 역할을 하며, 유전학자나 신경과 의사와는 어떻게 상호작용해야 할까요? MH에 유전적 소인이 있는 병리적인 DNA 변이에 대해 가족들에게 알리는 책임은 누구에게 있을까요? MH 에피소드를 경험한 환자를 치료하는 전문가들은 환자가 완전한 회복을 기대할 수 있는지 이해하는 데 도움을 줄 수 있지만, 환자가 근육분해증이나 근육 약화에 취약한지, 그리고 그 상태가 얼마나 지속될지에 대한 더 오래 지속되는 질문에 대해선 답변하기 어려울 수 있습니다. 전자 의무 기록에 특정 유전자 변이를 포함한 MHS 진단을 표시하는 방법이 보장되어야 합니다. 유전자 검사 플랫폼 전반에 걸쳐 데이터를 처리하고 이러한 중요한 진단을 의사에게 전달하는 방법을 개선할 수 있는 인공지능 또는 타사 서비스를 통해 MHS 환자를 더욱 안전하게 치료할 수 있습니다. 촉발제에 노출된 MHS 환자의 급성 MH 발병률은 알려져 있지 않으며 추정하기가 어렵지만, 모든 MHS 환자는 “깨끗한” 비촉발 마취 기술로 치료해야 합니다.9~11 여기에는 석시닐콜린과 휘발성 마취제 사용 금지, 마취 기계를 준비할 때 회로와 환기기를 제조업체에서 권장한 시간 이상으로 고유량으로 세척하거나 활성탄 필터를 호흡 회로에 삽입하며, 신선한 CO2 흡수제 사용, 우발적 사용을 방지하기 위해 증발기 차단 등이 포함됩니다. 수술 중 모니터링에는 EKG, 맥박 산소 측정, 혈압, 심부 체온, 전신 마취를 위한 호기말 이산화탄소 분압 측정이 포함되어야 합니다.12
마지막으로 MH는 전 세계 국가에서 보고되었으며 MHS에 대한 민족적 성향은 알려진 바가 없습니다. 더 넓은 공공 건강 문제는 자원이 제한된 국가들이 드물게 발생하는 질환인 악성 고온증(MH)에 대해 생명을 구하는 약물인 단트롤렌의 비용과, 더 자주 발생하는 질환에 대한 지출의 균형을 어떻게 맞출 것인가 하는 것입니다. 2024년 2월호 Anesthesiology에 실린 중국의 한 보고서에 따르면 단트롤렌이 없는 지역에서 MH로 인한 사망률이 50% 이상으로 보고되었습니다.13 미국에서는 휘발성 약을 일상적으로 사용하지 않고 응급 기도 관리를 위해 석시닐콜린을 보유하고 있는 통원 시설이 단트롤렌을 비축해야 하는지 여부에 관한 의문이 제기되었지만, 단트롤렌을 비축하는 것은 촉발제를 사용할 수 있는 안전한 환자 치료에 비용 효율적이고 최적임을 보여주는 증거가 있습니다.14~17
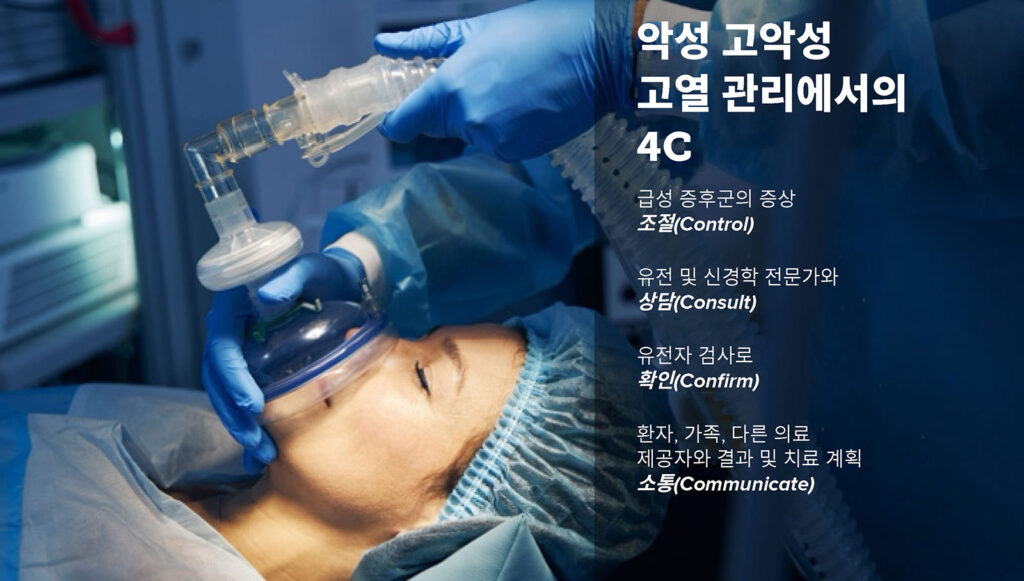
MH 관리의 네 가지 C
우리의 의견으로는, MH 증후군에 대한 관점을 넓혀 이 문제를 마취학과 외과만의 문제가 아닌 것으로 바라볼 때가 되었다고 생각합니다. 우리는 급성 MH 에피소드를 관리하는 것에 그치지 않고, 적절한 후속 관리와 잠재적으로 연관된 기타 골격근 관련 질환의 평가도 포함하는 환자 치료 목표를 확장해야 합니다. 진단, 치료, 환자와 가족의 유전 상담에 대한 다학제간 접근 방식이 무엇보다 중요합니다. 그러므로 MH 관리의 4C를 제안합니다.
- 급성 증후군 제어(Control)
- 유전 및 신경학 동료와 상담(Consult)
- 유전자 검사로 확인(Confirm)
- 환자, 가족, 다른 의료 제공자와 결과 및 치료 계획 소통(Communicate)
다음 단계
향후 MHS 환자의 치료를 개선하기 위해 이러한 조치를 취하는 것은 마취 전문가의 업무 범위에 포함됩니다. MH에 대한 인식 있는 관리는 APSF와 다른 환자 안전 기구들의 목표와 일치합니다. 다음 단계는 다음과 같습니다. 1) 미국 악성 고열 협회(Malignant Hyperthermia Association of the United States, MHAUS)의 MHS 진단 검사 권고안을 의심되는 모든 MH 사례에 대해 유전자 검사를 포함하도록 개정, 2) MH를 관리하는 마취 전문가와 임상 유전학자, 유전자 검사 플랫폼, MH에 익숙한 신경과 전문의를 연결하는 시스템 창출, 3) 전자 의무 기록에 MHS 진단 기재 보장, 4) 촉발제를 사용할 수 있는 모든 센터에 딘트롤렌을 비축하도록 권장하는 것을 비롯해 세계적으로 MH 교육 보급.
Henry Rosenberg(MD)는 미국 악성 고열 협회(Malignant Hyperthermia Association of the United States, MHAUS)의 명예 회장입니다.
Anjan Saha(MD)는 뉴욕주 뉴욕 컬럼비아 대학교의 임상 마취과 3년 차(CA3) 레지던트(Apgar Scholars 프로그램)입니다.
Carla D. Zingariello(DO)는 플로리다주 게인즈빌 플로리다 대학교 의과대학 소아과 조교수입니다.
Sandra Natalia Gonzalez(MD, FAAP)는 플로리다주 게인즈빌 플로리다 대학교 의과대학 마취과 조교수입니다.
Teeda Pinyavat(MD)는 뉴욕주 뉴욕 컬럼비아 대학교 마취과 부교수입니다.
Henry Rosenberg(MD)는 MHAUS 명예 회장이며 MHAUS 이사회 회원입니다.
Anjan Saha(MD)는 Deoxylytics라는 신생 기업의 주주입니다. Deoxylytics는 게놈 약학 기업입니다.
Carla Zingariello(DO)는 ML Bio의 임상시험 연구 책임자이며 ML Bio 컨설턴트를 맡은 적이 있습니다.
Sandra Natalia Gonzalez, MD는 이해관계 상충이 없습니다.
Teeda Pinyavat(MD)는 MHAUS 이사회 회원입니다.
참고 문헌
- Rosenberg H, Pollock N, Schiemann A, et al. Malignant hyperthermia: a review. Orphanet J Rare Dis. 2015;10:93. PMID: 26238698
- Witting N, Laforêt P, Voermans NC, et al. Phenotype and genotype of muscle ryanodine receptor rhabdomyolysis-myalgia syndrome. Acta Neurol Scand. 2018;137:452–461. PMID: 29635721
- Denborough MA. Malignant hyperthermia. 1962. Anesthesiology. 2008;108:156–157.
- Malignant Hyperthermia Association of the United States (MHAUS) Professional Advisory Council. “What should be on an MH cart?” MHAUS.org. https://www.mhaus.org/healthcare-professionals/be-prepared/what-should-be-on-an-mh-cart/. Accessed July 20, 2024.
- Fiszer D, Shaw MA, Fisher NA, et al. Next-generation sequencing of RYR1 and CACNA1S in malignant hyperthermia and exertional heat illness. Anesthesiology. 2015;122:1033–1046. PMID: 25658027
- Hopkins PM, Rüffert H, Snoeck MM, et al. on behalf of European Malignant Hyperthermia Group. European Malignant Hyperthermia Group guidelines for investigation of malignant hyperthermia susceptibility. Br J Anaesth. 2015;115:531–539. PMID: 26188342
- “Invitae Malignant Hyperthermia Susceptibility Panel.” Invitae. https://www.invitae.com/us/providers/test-catalog/test-03285. Accessed July 20, 2024.
- “Metabolic Myopathy and Rhabdomyolysis Panel.” Blueprint Genetics. https://blueprintgenetics.com/tests/panels/neurology/metabolic-myopathy-and-rhabdomyolysis-panel/. Accessed July 20, 2024.
- Ibarra Moreno CA, Hu S, Kraeva N, et al. An assessment of penetrance and clinical expression of malignant hyperthermia in individuals carrying diagnostic ryanodine receptor 1 gene mutations. Anesthesiology. 2019;131:983–991. PMID: 31206373
- Shaw MA, Hopkins PM; Mission impossible or mission futile?: estimating penetrance for malignant hyperthermia. Anesthesiology. 2019;131:957–959. PMID: 31335544
- Yu KD, Betts MN, Urban GM, et al. Evaluation of malignant hyperthermia features in patients with pathogenic or likely pathogenic RYR1 variants disclosed through a population genomic screening program. Anesthesiology. 2024; 140:52–61. PMID: 37787745
- Rüffert H, Bastian B, Bendixen D, et al. European Malignant Hyperthermia Group. Consensus guidelines on perioperative management of malignant hyperthermia suspected or susceptible patients from the European Malignant Hyperthermia Group. Br J Anaesth. 2021;126:120–130. PMID: 33131754
- Yu H, Tan L, Deng X. Improving dantrolene mobilization in regions with limited availability. Anesthesiology. 20241;140:1201–1202. PMID: 38329334
- Joshi GP, Desai MS, Gayer S, Vila H Jr. Society for Ambulatory Anesthesia (SAMBA). Succinylcholine for emergency airway rescue in class B ambulatory facilities: the Society for Ambulatory Anesthesia position statement. Anesth Analg. 2017;124:1447–1449. PMID: 27984222
- Litman RS, Smith VI, Larach MG, et al. Consensus statement of the Malignant Hyperthermia Association of the United States on unresolved clinical questions concerning the management of patients with malignant hyperthermia. Anesth Analg. 2019;128:652–659. PMID: 30768455
- Larach MG, Klumpner TT, Brandom BW, et al.; Multicenter Perioperative Outcomes Group. Succinylcholine use and dantrolene availability for malignant hyperthermia treatment: database analyses and systematic review. Anesthesiology. 2019;130:41–54. PMID: 30550426
- Aderibigbe T, Lang BH, Rosenberg H, et al. Cost-effectiveness analysis of stocking dantrolene in ambulatory surgery centers for the treatment of malignant hyperthermia. Anesthesiology. 2014;120:1333–1338. PMID: 24714119


 Issue PDF
Issue PDF