Все больше информации подтверждает связь между ИОГ и неблагоприятными послеоперационными исходами — наиболее значительно с острым поражением почек (ОПП), повреждением миокарда после некардиальных хирургических вмешательств и летальностью. В недавних исследованиях также была определена связь ИОГ с делирием, инсультом и повторной госпитализацией. Осложнения, связанные с ИОГ, создают серьезные последствия для пациентов и системы здравоохранения в целом. ИОГ — это модифицируемый риск, с которым связаны значительные различия в практике и к которому не следует относиться терпимо.
Пациенты часто просят анестезиологов позаботиться о них. И хотя мы можем уверенно обещать им это, многие анестезиологи могут не знать о растущем объеме данных, связанных с заболеваемостью и смертностью пациентов из-за интраоперационной гипотензии (ИОГ). Все больше информации подтверждает связь между ИОГ и неблагоприятными послеоперационными исходами — наиболее значительно с острым поражением почек (ОПП), повреждением миокарда после некардиальных хирургических вмешательств и летальностью1–9. В недавних исследованиях также была определена связь ИОГ с делирием, инсультом и повторной госпитализацией1,4,9–11. Осложнения, сопряженные с ИОГ, создают серьезные последствия для пациентов и системы здравоохранения в целом. Одно ОПП связано с развитием таких осложнений, как инсульт, повреждение миокарда, хроническая болезнь почек, а также со смертностью как в больнице, так и в течение года после операции, увеличением продолжительности пребывания в стационаре, использования ресурсов здравоохранения и расходов на медицинское обслуживание4,12,13. Анестезиологи могут не знать об этих тревожных данных, особенно если им не сообщают об исходах операций. Эти данные свидетельствуют о необходимости уменьшения частоты ИОГ, чтобы снизить причинение вреда пациентам.
ИОГ — падение артериального давления (АД) ниже «безопасного порогового значения», что приводит к недостаточной перфузии органов1–9. Частота возникновения ИОГ зависит от используемого определения, которое может включать как снижение АД, так и продолжительность этого снижения. В рамках одного исследования была оценена взаимосвязь ИОГ и исходов в виде ОПП и повреждения миокарда2. Для определения ИОГ использовалось как относительное снижение по сравнению с исходным уровнем (т. е. на 20 % ниже предоперационного АД), так и абсолютное пороговое значение. Было обнаружено, что абсолютное и относительное пороговые значения обладают сопоставимой способностью отличать пациентов с повреждением миокарда или почек от пациентов без повреждения, что позволяет предположить использование абсолютного порогового значения. Эпизоды падения среднего артериального давления (САД) ниже 65 мм. рт. ст. в течение одной минуты были связаны с повышенным риском ОПП и повреждения миокарда2, причем риск увеличивался пропорционально длительности ИОГ2. Это открытые привело к определению ИОГ как эпизода падения САД ниже 65 мм. рт. ст. в течение не меньше одной минуты2.
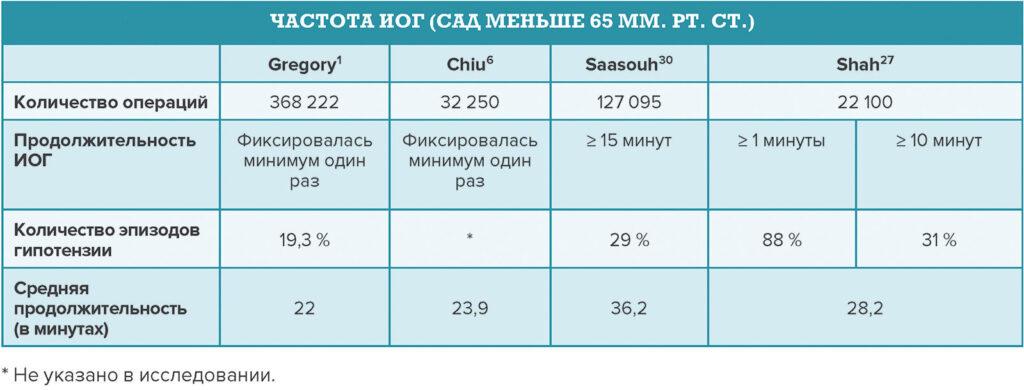
Обзор доступной литературы об ИОГ, опубликованной с 2017 по конец 2022 года, в сочетании с соответствующими недавними исследованиями показывает, что наиболее распространенными определениями ИОГ являются любое падение САД ниже 65 мм. рт. ст.1,4,6,10,14–18 или такое падение продолжительностью не меньше одной минуты8,10,19–26. При использовании этого абсолютного значения САД ИОГ встречается на удивление часто. В недавнем ретроспективном обсервационном исследовании, включавшем более 22 000 пациентов из разных центров, сообщалось, что 88 % лиц, перенесших некардиохирургические операции, испытали как минимум один эпизод ИОГ со средней продолжительностью 28,2 минуты (таблица 1)27. Авторы отметили значительные различия в практике ведения ИОГ в одиннадцати медицинских центрах, что свидетельствует о несоответствии врачей в определении порогового предела ИОГ27.
Таблица 1. Сравнение частоты ИОГ в четырех исследованиях.
Центры обслуживания программ Medicare и Medicaid (Centers for Medicare and Medicaid Services, CMS) признают новый качественный показатель ИОГ, определяемый как САД меньше 65 мм рт. ст. в течение более 15 минут, в качестве критерия в Системе поощрительных выплат на основе результативности (Merit-Based Incentive Payment System, MIPS)28. Более низкий общий балл показателя ИОГ указывает на меньшее время пребывания пациента с определенным САД28. Балл MIPS суммируется на основе показателей качества, мероприятий по улучшению, продвижения взаимодействия и стоимости. Показатель ePreop31 является одним из шести анестезиологических показателей, которые могут быть представлены для оценки качества в рамках MIPS28,29. Окончательный показатель MIPS определяет сумму, покрываемую в рамках части B программы Medicare29. Недавнее исследование с использованием определения ИОГ в рамках MIPS от CMS показало, что частота ИОГ в общей анестезиологической практике составляет 29 % при проведении некардиохирургических процедур30. Это исследование выявило различную частоту ИОГ у пациентов разных анестезиологов, что дополняет совокупность сведений, подтверждающих снижение вариативности практики в управлении ИОГ14,30,31. Авторы считают ИОГ модифицируемым фактором риска и предлагают проводить инициативы по улучшению качества, чтобы устранить различия врачей в определении порогового предела ИОГ30.
Общей характерной особенностью ИОГ, независимо от ее определения, является то, что более серьезные степени гипотензии и более длительная совокупная ее продолжительность связаны с повышенным риском заболеваемости и летальности пациентов. Многочисленные исследования подтверждают связь длительных эпизодов САД меньше 65 мм рт. ст. либо эпизодов САД менее 55 мм рт. ст. любой продолжительности с большим риском неблагоприятных исходов1–3,9,16,17,32. Следовательно, нам просто необходимо минимизировать частоту, степень тяжести и продолжительность ИОГ.
Решение этой задачи может быть затруднено при использовании традиционного прерывистого осциллометрического мониторирования АД с помощью манжеты на руке. С осциллометрическим методом связаны задержка или пропуск обнаружения изменений АД либо гипотензивных эпизодов, низкая точность при экстремальных параметрах гемодинамики, а также завышение АД при гипотензии, приводящее к более тяжелым последствиям, чем предполагалось19,33. Вероятность пропуска гипотензивных эпизодов при использовании осциллометрического метода зависит от частоты измерений или настроек по умолчанию на мониторе жизненных показателей. В одном недавнем исследовании было выявлено, что наиболее частая периодичность измерения с помощью осциллометрического метода составляет каждые две — пять минут25. Такая нечастая периодичность приводит к незамеченному увеличению продолжительности гипотензии между измерениями, а значит — к большему риску причинения вреда пациенту. Эту проблему можно решить с помощью непрерывного мониторинга15,19,25.
Новые исследования подтверждают преимущества непрерывного мониторинга АД перед осциллометрическим методом, в частности меньшую вариативность значений АД16, улучшенную гемодинамическую стабильность33, выявление упущенных при осциллометрическом методе эпизодов гипотензии19, раннее распознавание и лечение ИОГ15,25, а также уменьшение таких эпизодов в целом15,19,25,33. Непрерывный мониторинг бывает как внутриартериальным (со следующими рисками: инфекция, повреждение нервов, образование тромба и псевдоаневризма)25, так и неинвазивным с пальцевой манжетой (устраняет риски, связанные с инвазивным измерением, и позволяет получить сопоставимые значения САД)25,33. Последняя технология имеет недостатки в виде дополнительных затрат и меньшей точности у пожилых пациентов или пациентов с атеросклерозом25,34,35. В неинвазивной пальцевой манжете, описанной в последних исследованиях, применяется технология объемной компенсации с использованием изменяющегося давления манжеты на артерии пальца, чтобы поддерживать постоянный объем25,33. Пальцевое АД реконструируется в форму артериальной волны, что позволяет проводить анализ пульсовой волны для получения расширенных гемодинамических показателей (например, ударного объема, его изменения и сердечного выброса), которые помогают определить причины ИОГ25. Неинвазивная пальцевая манжета может быть подходящим вариантом для непрерывного мониторинга АД, когда нет необходимости брать образцы артериальной крови во время хирургической процедуры33.
Врачам необходимо свести к минимуму частоту, степень тяжести и продолжительность ИОГ
Неправильное введение жидкости или вазопрессоров может вызвать гипоперфузию органа, а затем — его повреждение. Это подтверждает необходимость применения целенаправленных стратегий для устранения таких проблем1,3,6,7,12,32. Ariyarathna et al. описали взаимосвязь частого использования вазопрессоров и послеоперационного ОПП, независимо от ИОГ12. В другом исследовании было высказано предположение, что введение ограничения жидкости в рамках протокола ускоренного восстановления после операции (Enhanced Recovery after Surgery, ERAS) было связано со значительным увеличением послеоперационной гипотензии31. В этом исследовании пациенты с послеоперационной гипотензией испытывали более значительную ИОГ и получали меньший объем жидкости во время операции. В недавнем пятилетнем многоцентровом ретроспективном исследовании Многоцентровой группы периоперационных исходов (Multicenter Perioperative Outcomes Group, MPOG), в котором приняли участие более 32 000 пациентов, перенесших внутрибрюшную операцию, было отмечено увеличение частоты ОПП, несмотря на общее снижение ИОГ6. Кроме того, было выявлено уменьшение количества эпизодов интраоперационного введения жидкости и увеличение использования вазопрессоров, и обе эти тенденции были связаны с повышением уровня возникновения ОПП. При увеличении объема введения кристаллоидов с одного до десяти миллилитров на килограмм в час (мл/кг/час) наблюдалось снижение риска ОПП на 58 %. Эти данные подтверждают физиологическую концепцию, согласно которой использование вазопрессоров для поддержания АД при минимальном введении жидкости может привести к снижению уже нарушенной висцеральной и почечной перфузии, а также вызвать ятрогенные повреждения в виде кишечной непроходимости, послеоперационной тошноты и рвоты, инфекции в области хирургического вмешательства и ОПП6,7,12,36.
Причины ИОГ многофакторны и включают снижение сократительной способности миокарда, вазодилатацию, гиповолемию, брадикардию, сдавление камер сердца извне (например, перикардиальный выпот или пневмоторакс) либо имеют «смешанный тип», объясняемый несколькими гемодинамическими изменениями8,18. Использование расширенного мониторинга гемодинамических показателей (например, ударного объема, его изменения и сердечного выброса) может быть эффективным для предотвращения, диагностики и лечения гипотензии8. В этом случае мероприятия могут быть направлены на устранение первопричины ИОГ с помощью стратегии целенаправленной терапии (Goal-Directed Therapy, GDT), а не просто на улучшение показателя САД, отображаемого на мониторе жизненных показателей.
GDT — это собирательный термин, описывающий оптимальное введение в наиболее подходящее время жидкостей, инотропов и вазопрессоров на основе данных расширенного мониторинга гемодинамических показателей. Интраоперационные вмешательства в рамках GDT ориентированы на достижение конкретных показателей и целей для оптимизации доставки кислорода к тканям и предотвращения гипоперфузии органов (рисунок 1)5,17. Реакция пациента на эти вмешательства оценивается с помощью монитора гемодинамических параметров. Основой для современной концепции GDT послужила целенаправленная инфузионная терапия (Goal-Directed Fluid Therapy, GDFT). Расширенный мониторинг гемодинамики используется, чтобы выявлять зависимость от преднагрузки, помогать в принятии решения о болюсе(‑ах) жидкости для оптимизации положения пациента на кривой Франка-Старлинга, а затем оценивать реакцию на жидкость7,17. В консенсусном заявлении по контролю жидкостями, принятом в рамках Инициативы по качеству периоперационных вмешательств (Perioperative Quality Initiative, POQI) в 2020 году, подтверждается, что наиболее безопасным и эффективным методом управления инфузионной терапией является предварительная оценка реакции на жидкость7. Кроме того, оптимизация ударного объема (Stroke Volume, SV) с помощью жидкостей приводит к улучшению перфузии желудочно-кишечного тракта и снижению количества осложнений, что указывает на важность адекватного объема циркулирующей жидкости и перфузии кишечника36. Целенаправленная гемодинамическая терапия (Goal-Directed Hemodynamic Therapy, GDHT), являющаяся еще одним компонентом GDT, предусматривает усовершенствованную первоначальную стратегию GDFT, а также включение в протокол поддержания САД для предотвращения ИОГ17. Стратегии GDT, включающие оптимизацию гемодинамики, связаны со значительным снижением заболеваемости и летальности5,11,32. На рисунке 1 представлена современная концепция GDT, содержащая компоненты, на основе которых она создана, и представляющая всю картину перфузии.
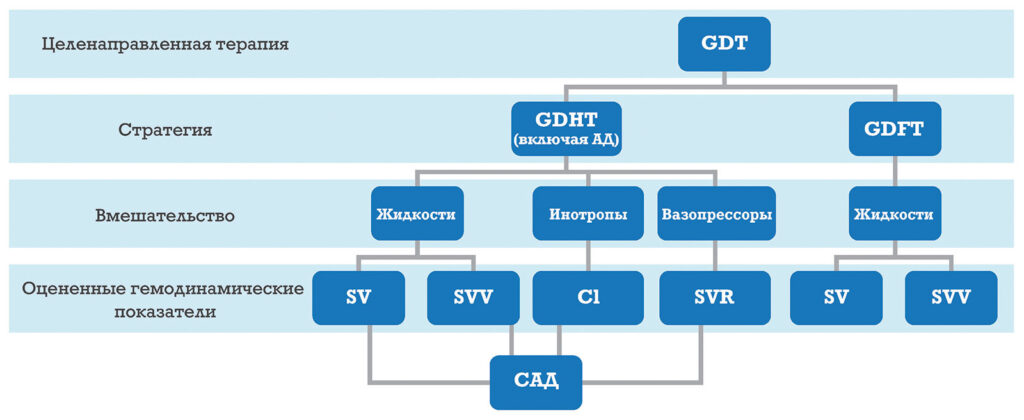
Рисунок 1. Изображение составляющих стратегии GDT, которая основывается на комбинации GDHT и GDFT, а также гемодинамических показателей, стимулирующих проведение целенаправленных вмешательств.
GDT: Целенаправленная терапия; GDHT: Целенаправленная гемодинамическая терапия; GDFT: Целенаправленная инфузионная терапия; SV: Ударный объем;
SVV: Изменение ударного объема; CI: Сердечный индекс; SVR: Системное сосудистое сопротивление; САД: Среднее артериальное давление.
Многочисленные исследования с использованием расширенного мониторинга гемодинамических показателей и GDT, ориентированной на определение подходящего лечения в зависимости от причины (причин) ИОГ и оптимизации гемодинамики, показали значительное снижение послеоперационных осложнений5,11,24,32. Одно из исследований показало, что использование протокола GDHT снижает осложнения и продолжительность пребывания в больнице у хирургических пациентов с низким и умеренным риском в знаковом клиническом исследовании FEDORA5. Другое исследование включало применение этого протокола у пациентов, перенесших обширное хирургическое вмешательство. Благодаря этому удалось уменьшить риск послеоперационной дисфункции органов32. Одним из достоинств этого более позднего исследования был протоколированный гемодинамический алгоритм, использованный для управления введением жидкости с целью оптимизации SV, тем самым поддерживая внутрисосудистый объем и перфузионное давление в органах, а также защищая их от гипоперфузии. В исследовании, которое включало проведение пожилым пациентам операций на позвоночнике, применение протокола GDT привело к сокращению случаев ИОГ, послеоперационной тошноты и рвоты, а также делириума по сравнению с контрольной группой11. Кроме того, другие исследования, заключавшиеся в использовании GDT, привели к таким же результатам, что подтвердило эффективность такой терапии в борьбе с ИОГ21,23,24. Было выявлено, что GDT является результативной для широкого круга пациентов, в частности с низким, умеренным и высоким риском.
ИОГ — серьезная проблема в сфере общественного здравоохранения
В статье 2021 года о связи ИОГ и неблагоприятных исходов ИОГ была описана как серьезная проблема в сфере общественного здравоохранения, недопустимая для любой возрастной группы, независимо от продолжительности1. Ввиду размера популяции, подверженной риску ИОГ, авторы настоятельно рекомендовали проведение дальнейших исследований о предотвращении ИОГ. Подход с традиционным мониторингом гемодинамических показателей состоит в реактивном лечении ИОГ после ее обнаружения, что слишком поздно, поскольку в этот момент гипотензия уже вызывает повреждение органов20. В статье Информационного бюллетеня APSF 2021 года Сесслер (Sessler) упоминал о преимуществах прогнозирования ИОГ с помощью последних технологических достижений в сфере искусственного интеллекта и машинного обучения37. После этого были опубликованы многочисленные исследования, подтверждающие целесообразность использования новых технологий для точного прогнозирования и уменьшения эпизодов ИОГ8,20–23,26. Одной из таких доступных технологий прогнозирования вероятности возникновения ИОГ и определения ее первопричины, является использование индекса прогнозирования гипотензии (Hypotension Prediction Index, HPI). Этот индекс представлен в виде безразмерного числа на шкале от 0 до 100, указывающего на вероятность возникновения эпизода гипотензии38. Использование данных, предоставленных монитором, о первопричине надвигающейся ИОГ позволяет врачу провести правильное целенаправленное лечение, тем самым предотвратив ИОГ. В систематическом обзоре рандомизированных контролируемых клинических исследованиях, оценивающих способность HPI сокращать ИОГ, авторы утверждают, что HPI способен уменьшать частоту, длительность и степень тяжести ИОГ во время некардиоихирургических операций. При этом важно следовать протоколу управления при использовании этой технологии22. Этот вывод дополнительно подтверждает роль снижения вариативности практики в уменьшении частоты ИОГ.
Анестезиологи стремятся оказывать пациентам оптимальную помощь, однако могут не знать о потенциальных пагубных последствиях, вызванных мониторингом гемодинамических показателей. Как решительно заявили Gregory et al., ИОГ является проблемой в сфере общественного здравоохранения, которую необходимо свести к минимуму1. Для этого можно применить пошаговый подход. На рисунке 2 приведены дальнейшие шаги от авторов этой статьи и недавно опубликованные консенсусные рекомендации, а также передовые методы APSF39.
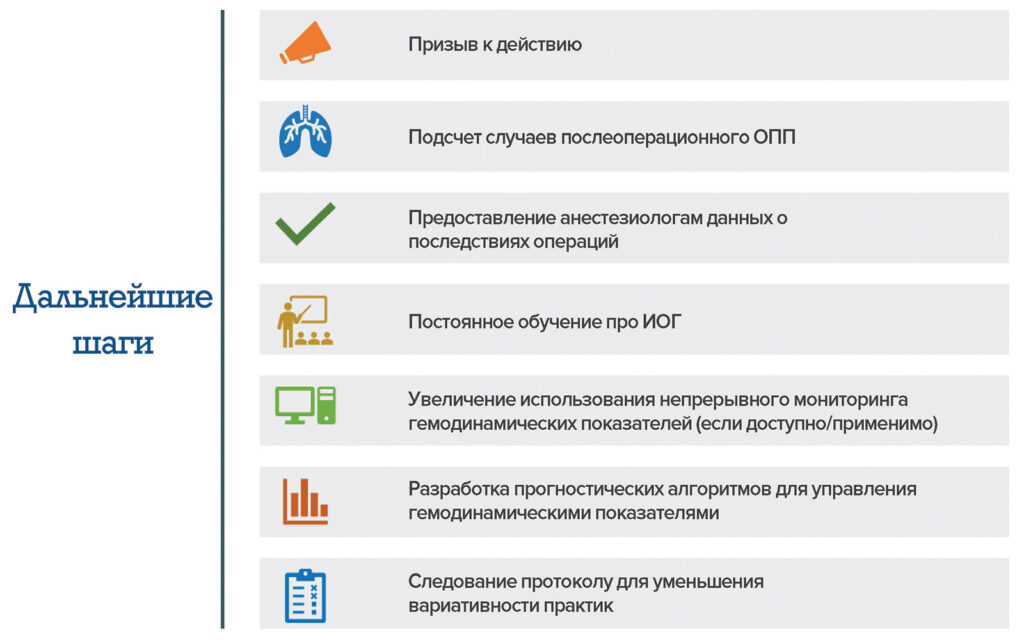
Рисунок 2. Рекомендуемые дальнейшие шаги для анестезиологов. На рисунке приведены недавно опубликованные консенсусные рекомендации, а также передовые методы APSF, способствующие минимизации ИОГ и связанного с ней вреда для пациентов39.
ОПП: острое поражение почек; ИОГ: интраоперационная гипотензия.
Нам необходимо признать, что ИОГ является распространенной проблемой, и повышать осведомленность анестезиологов о ней путем обучения и отслеживания послеоперационных исходов, включая случаи ОПП и повреждения миокарда после некардиохирургических операций. Мы должны вести постоянный мониторинг расширенных гемодинамических показателей, если это уместно, чтобы избежать необнаружения ИОГ. Нам следует правильно управлять гемодинамическими показателями, балансируя кровообращение для устранения проблемы (например, с помощью протокола GDT), а не исправлять вазопрессорами цифру на мониторе. ИОГ — это модифицируемый риск, к которому не следует относиться терпеливо.
Эми Йердон, доктор сестринской практики, помощник по введению лекарств среднего медицинского работника, сертифицированный зарегистрированный средний медицинский работник — анестезист, сертифицированный специалист по обучению средних медицинских работников, сертифицированный специалист по симулированному обучению в сфере здравоохранения, является доцентом в Школе сестринского дела при Университете Алабамы в Бирмингеме (University of Alabama at Birmingham School of Nursing) и заместителем директора программы Nurse Anesthesia Program, г. Бирмингем, штат Алабама.
Мэтью Шеррер, дипломированный врач, магистр делового администрирования, член Американской коллегии анестезиологов (FASA) и Американской коллегии руководителей клинических программ по анестезиологии (FAACD), является ассистентом кафедры анестезиологии и периоперационной медицины при Университете Алабамы в Бирмингеме, г. Бирмингем, штат Алабама.
Дезири Чаппелл, магистр наук в области сестринской анестезии, сертифицированный зарегистрированный средний медицинский работник — анестезист, член Американской ассоциации медсестер по анестезиологии (FAANA), является вице-президентом по клиническому качеству, клиники Northstar Anesthesia, г. Луисвилл, штат Кентукки.
Эми Йердон, доктор сестринской практики, помощник по введению лекарств среднего медицинского работника, сертифицированный зарегистрированный средний медицинский работник — анестезист, является членом бюро докладчиков компании Edwards Lifesciences. Д. Мэтью Шеррер, дипломированный врач, магистр делового администрирования, член FASA и FAACD, заявил об отсутствии конфликта интересов. Дезири Чаппелл, магистр наук в области сестринской анестезии, сертифицированный зарегистрированный средний медицинский работник — анестезист, член FAANA, является главным редактором и ведущей TopMedTalk, членом бюро докладчиков компаний Edwards Lifesciences и Medtronic, а также входит в состав консультативного совета Provation.
СПИСОК ЛИТЕРАТУРЫ
- Gregory A, Stapelfeldt W, Khanna A, et al. Intraoperative hypotension is associated with adverse clinical outcomes after noncardiac surgery. Anesth Analg. 2021 ;132:1654–1665. PMID: 33177322.
- Salmasi V, Maheshwari K, Yang D, et al. Relationship between intraoperative hypotension, defined by either reduction from baseline or absolute thresholds, and acute kidney and myocardial injury after noncardiac surgery: a retrospective cohort analysis. Anesthesiology. 2017;126:47–65. PMID: 27792044.
- Wesselink E, Kappen T, Torn H, et al. Intraoperative hypotension and the risk of postoperative adverse outcomes: a systematic review. Br J Anaesth. 2018;121:706–721. PMID: 30236233.
- Stapelfeldt WH, Khanna AK, Shaw AD, et al. Association of perioperative hypotension with subsequent greater healthcare resource utilization. J Clin Anesth. 2021;75. PMID: 34536719.
- Calvo-Vecino JM, Ripollés-Melchor J, Mythen MG, et al. Effect of goal-directed haemodynamic therapy on postoperative complications in low–moderate risk surgical patients: a multicentre randomized controlled trial (FEDORA trial). Br J Anaesth. 2018;120:734–744.
- Chiu C, Fong N, Lazzaresch, D, et al. Fluids, vasopressors, and acute kidney injury after major abdominal surgery between 2015 and 2019: A multicentre retrospective analysis. Br J Anaesth. 2022;12:317–326. PMID: 29576114.
- Martin GS, Kaufman DA, Marik PE, et al. Perioperative Quality Initiative (POQI) consensus statement on fundamental concepts in perioperative fluid management: fluid responsiveness and venous capacitance. Perioper Med (Lond). 2020;9:1–12. PMID: 32337020.
- Ranucci M, Barile L, Ambrogi F, Pistuddi V. Surgical and Clinical Outcome Research (SCORE) Group. Discrimination and calibration properties of the hypotension probability indicator during cardiac and vascular surgery. Minerva Anestesiol. 2019;85:724–730. PMID: 30481996.
- Putowski Z, Czajka S, Krzych ŁJ. Association between intraoperative BP drop and clinically significant hypoperfusion in abdominal surgery: a cohort study. J Clin Med. 2021;10(21):5010. PMID: 34768530.
- Maheshwari K, Ahuja S, Khanna AK, et al. Association between perioperative hypotension and delirium in postoperative critically ill patients: a retrospective cohort analysis. Anesth Analg. 2020;130:636–643. PMID: 31725024.
- Zhang N, Liang M, Zhang D, et al. Effect of goal-directed fluid therapy on early cognitive function in elderly patients with spinal stenosis: a case-control study. Int J Surg. 2018;54:201–205. PMID: 29678619.
- Ariyarathna D, Bhonsle A, Nim J, et al. Intraoperative vasopressor use and early postoperative acute kidney injury in elderly patients undergoing elective noncardiac surgery. Ren Fail. 2022;44:648–659. PMID: 35403562.
- French WB, Shah PR, Fatani YI, et al. Mortality and costs associated with acute kidney injury following major elective, non-cardiac surgery. J Clin Anesth. 2022;82:110933. PMID: 35933842.
- Christensen AL, Jacobs E, Maheshwari K, et al. Development and evaluation of a risk-adjusted measure of intraoperative hypotension in patients having nonemergent, noncardiac surgery. Anesth Analg. 2021;133:445–454. PMID: 33264120.
- Maheshwari K, Khanna S, Bajracharya GR, et al. A randomized trial of continuous noninvasive BP monitoring during noncardiac surgery. Anesth Analg. 2018;127:424–431. PMID: 29916861.
- Park S, Lee HC, Jung CW, et al. Intraoperative arterial pressure variability and postoperative acute kidney injury. Clin J Am Soc Nephrol. 2020;15:35–46. PMID: 31888922.
- French WB, Scott M. Fluid and hemodynamics. Anesthesiol Clin. 2022;40:59–71. PMID: 35236583.
- Kouz K, Brockmann L, Timmermann LM, et al. Endotypes of intraoperative hypotension during major abdominal surgery: a retrospective machine learning analysis of an observational cohort study. Br J Anaesth. 2023;130:253–261. PMID: 36526483.
- Kouz K, Weidemann F, Naebian A, et al. Continuous finger-cuff versus intermittent oscillometric arterial pressure monitoring and hypotension during induction of anesthesia and noncardiac surgery: the DETECT Randomized Trial. Anesthesiology. 2023;139:298–308. PMID: 37265355.
- Frassanito L, Giuri PP, Vassalli F, et al. Hypotension Prediction Index with non-invasive continuous arterial pressure waveforms (ClearSight): clinical performance in gynaecologic oncologic surgery. J Clin Monit Comput. 2022;36:1325–1332. PMID: 34618291.
- Grundmann CD, Wischermann JM, Fassbender P, et al. Hemodynamic monitoring with Hypotension Prediction Index versus arterial waveform analysis alone and incidence of perioperative hypotension. Acta Anaesthesiol Scand. 2021;65:1404–1412. PMID: 34322869.
- Li W, Hu Z, Yuan Y, Liu J, Li K. Effect of hypotension prediction index in the prevention of intraoperative hypotension during noncardiac surgery: a systematic review. J Clin Anesth. 2022;83:110981. PMID: 36242978.
- Schneck E, Schulte D, Habig L, et al. Hypotension Prediction Index based protocolized haemodynamic management reduces the incidence and duration of intraoperative hypotension in primary total hip arthroplasty: a single centre feasibility randomised blinded prospective interventional trial. J Clin Monit Comput. 2020;34:1149–1158. PMID: 31784852.
- Wijnberge M, Geerts BF, Hol L, et al. Effect of a machine learning-derived early warning system for intraoperative hypotension vs standard care on depth and duration of intraoperative hypotension during elective noncardiac surgery: the HYPE randomized clinical trial. JAMA. 2020;323:1052–1060. PMID: 32065827.
- Wijnberge M, van der Ster B, Vlaar APJ, et al. The effect of intermittent versus continuous non-invasive BP monitoring on the detection of intraoperative hypotension, a sub-study. J Clin Med. 2022;11:4083. PMID: 35887844.
- Kouz K, Monge García MI, Cercutti E, et al. Intraoperative hypotension when using hypotension prediction index software during major noncardiac surgery: a European multicentre prospective observational registry (EU HYPROTECT). BJA Open. 2023;6:100140. PMID: 37588176.
- Shah N, Mentz G, Kheterpal S. The incidence of intraoperative hypotension in moderate to high risk patients undergoing non-cardiac surgery: a retrospective multicenter observational analysis. J Clin Anesth. 2020;66:1–12. PMID: 32663738.
- Provation. ePreop 31: Intraoperative hypotension (IOH) among non-emergent noncardiac surgical cases. 2020. https://www.provationmedical.com/wp-content/uploads/2022/08/ePreop-Provation_IOH_Specifications.pdf . Accessed March 2024.
- U.S. Centers for Medicare & Medicaid Services (CMS). Traditional MIPS overview. CMS Quality Payment Program. https://qpp.cms.gov/mips/traditional-mips. Accessed January 3, 3024.
- Saasouh W, Christensen AL, Xing F, et al. Incidence of intraoperative hypotension during non-cardiac surgery in community anesthesia practice: a retrospective observational analysis. Perioper Med (Lond). 2023;12:29. Published 2023 Jun 24. PMID: 37355641.
- Anolik RA, Sharif-Askary B, Hompe E, et al. Occurrence of symptomatic hypotension in patients undergoing breast free flaps: is enhanced recovery after surgery to blame? Plast Reconstr Surg. 2020;145:606–616. PMID: 32097291.
- Futier E, Lefrant JY, Guinot PG, et al. Effect of individualized vs standard BP management strategies on postoperative organ dysfunction among high-risk patients undergoing major surgery. JAMA. 2017;318:1346. PMID: 28973220.
- Meidert AS, Nold JS, Hornung R, et al. The impact of continuous non-invasive arterial BP monitoring on BP stability during general anaesthesia in orthopaedic patients: a randomised trial. Eur J Anaesthesiol. 2017;34:716–722. PMID: 28922340.
- Klose P, Lorenzen U, Berndt R, et al. Continuous noninvasive monitoring of arterial pressure using the vascular unloading technique in comparison to the invasive gold standard in elderly comorbid patients: a prospective observational study. Health Sci Rep. 2020;3:e204. PMID: 33204849.
- Maheshwari K, Buddi S, Jian Z, et al. Performance of the Hypotension Prediction Index with non-invasive arterial pressure waveforms in non-cardiac surgical patients. J Clin Monit Comput. 2021;35:71–78. PMID: 31989416.
- Davies SJ, Mythen M. Hemodynamic and intestinal microcirculatory changes in a phenylephrine corrected porcine model of hemorrhage. Anesth Analg. 2021;133:1060–1069. PMID: 33755645.
- Sessler D. Perioperative hypotension. APSF Newsletter. 2021;36:89–94. https://www.apsf.org/article/perioperative-hypotension/ . Accessed March 2024.
- Edwards Lifesciences. Acumen IQ sensor: minimally-invasive predictive decision support. https://www.edwards.com/healthcare-professionals/products-services/predictive-monitoring/acumen-iq-sensor. Accessed March 27, 2023.
- Scott MJ, and the APSF Hemodynamic Instability Writing Group. Perioperative patients with hemodynamic instability: consensus recommendations of the Anesthesia Patient Safety Foundation. Anesth Analg. 2024;138:713–724. PMID: 38153876.


 Issue PDF
Issue PDF