ВВЕДЕНИЕ
В 2009 году в Информационном бюллетенe APSF опубликовали информацию о постоянной проблеме безопасности пациентов, а именно о возникновении риска позднего тромбоза после установки стента с лекарственным покрытием.1 Было установлено, что тромбоз стента, хотя и встречается редко, является причиной инфаркта миокарда (ИМ) в 60 % случаев, а также смертности — в 45 %. Согласно ранним исследованиям на животных, полная эндотелизация при использовании непокрытых металлических стентов (BMS) наступает через 28 дней, в то время как в случае применения стентов нового поколения с лекарственным покрытием (DES) наблюдается неполное заживление в течение 180 дней.2 В 2008 году представители Американской коллегии врачей пульмонологов (American College of Chest Physicians, ACCP) рекомендовали не проводить плановое хирургическое вмешательство в течение 12 месяцев после установки DES3, тем самым обременив пациентов, нуждающихся в срочной операции. В связи с этим в 2009 году в Информационном бюллетене APSF опубликовали информацию об отсутствии общепринятых протоколов во время лечения пациентов, которым предстоит некардиохирургическое вмешательство после установки стента. Авторы подчеркнули необходимость совместного принятия решений с участием пациента, терапевта, хирурга, анестезиолога и кардиолога, заявив, что в ходе междисциплинарного обсуждения необходимо рассматривать тип стена и сроки его установки, характер и срочность предполагаемой операции, лечение периоперационной антитромбоцитарной терапией, а также выбор учреждения, в котором будет проводиться хирургическое вмешательство. Если пациентам с недавно установленным стентом необходимо провести операцию, то лучше всего это сделать в учреждении, где круглосуточно работает интервенционный кардиолог, поскольку экстренное чрескожное коронарное вмешательство (ЧКВ) до сих пор является лучшим вариантом лечения тромбоза стента.1

ДАТ — двойная антитромбоцитарная терапия; ACC — Американская коллегия врачей-кардиологов; AHA — Американская кардиологическая ассоциация; ESC — Европейское общество кардиологов
С того времени произошел значительный прогресс технологий, и рекомендуемая продолжительность двойной антитромбоцитарной терапии (ДАТ) кардинально изменилась. Стенты первого поколения представляли собой стандартный непокрытый металлический стент и имели полимерное покрытие на основе антирестенотического препарата, например сиролимуса или паклитаксела. Сейчас можно приобрести стенты нового поколения с лекарственным покрытием, например биодеградируемые полимерные или биорезорбируемые стенты. Было установлено, что с их помощью можно уменьшить риск возникновения тромбоза стента. Благодаря стентам нового поколения можно проводить более короткий курс ДАТ, не ставя при этом под угрозу безопасность пациента.
Возможно, самым важным фактором при выборе оптимальной продолжительности ДАТ является соотношение риска тромбоза стента и развития осложнений, связанных с кровотечением. По данным исследований, применение длительной ДАТ сопровождается повышенным риском кровотечений, особенно у пожилых пациентов или пациентов с сопутствующими заболеваниями.4,5 Из-за этого значительно повышается вероятность заболеваемости и смертности, при этом высокий риск кровотечения (ВРК) присутствует примерно у 40 % пациентов, которым назначают ЧКВ.5 Среди методов оценки риска кровотечений при проведении ДАТ используются шкала PRECISE-DAPT,6 а также критерии ВРК Академического исследовательского консорциума (Academic Research Consortium for High-Risk Bleeding, ARC-HBR).4
ДОКАЗАТЕЛЬСТВА В ПОЛЬЗУ ПРОВЕДЕНИЯ БОЛЕЕ КОРОТКОЙ ДАТ
 Высокий риск кровотечения определяется в зависимости от наличия хотя бы 1 критерия ВРК (см. табл. 1).⁷
Высокий риск кровотечения определяется в зависимости от наличия хотя бы 1 критерия ВРК (см. табл. 1).⁷
Во время проведения недавних двух исследований специалисты обследовали пациентов с высоким риском заболеваний, которым провели ЧКВ и назначили короткую ДАТ с применением либо монотерапии тикагрелором, либо тикагрелором и аспирином. Тикагрелор является пероральным обратимым антагонистом рецепторов P2Y12 прямого действия, благодаря которому обеспечивается более быстрое, значительное и устойчивое ингибирование тромбоцитов, чем во время применения клопидогреля. В ходе первого исследования было установлено, что использование тикагрелора в комбинации с аспирином в течение 1 месяца, а затем только тикагрелора способствует улучшению показателей у пациентов после проведения ЧКВ по сравнению с применением стандартной схемы антитромбоцитарной терапии.8 Согласно результатам второго исследования, у пациентов с высоким риском, которые имели ЧКВ и завершили терапию ДАТ продолжительностью 3 месяца, в ходе применения монотерапии тикагрелором наблюдалась меньшая частота клинически значимых кровотечений, чем при использовании тикагрелора с аспирином. При этом риск смерти, ИМ или инсульта не увеличивался.9
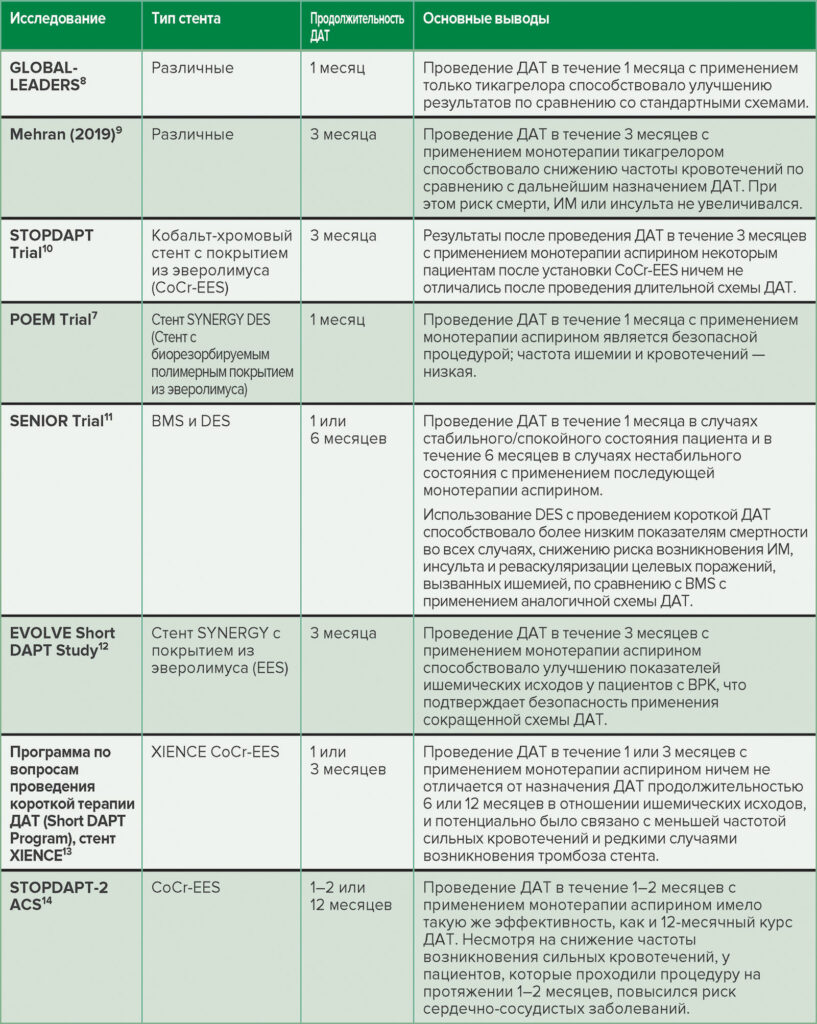
Кроме того, недавно опубликовали результаты нескольких основных исследований, в которых подчеркнули безопасность и эффективность прекращения терапии ДАТ в более ранние сроки (см. табл. 2). Эти новые стенты идеально подойдут для пациентов с ВРК. По результатам проведенных исследований, частота ишемии была ниже, что позволяет сократить продолжительность ДАТ. Это в свою очередь может также снизить риск кровотечений у пациентов. Использование стентов нового поколения имеет преимущества над применением непокрытых металлических, поскольку с их помощью можно снизить риск смертности от всех причин, например инфаркта миокарда, инсульта и реваскуляризации целевых поражений, вызванных ишемией.10-14
Таблица 2. Краткий обзор результатов недавних исследований, посвященных изучению сокращенных схем ДАТ.
РЕКОМЕНДАЦИИ ОБЩЕСТВ
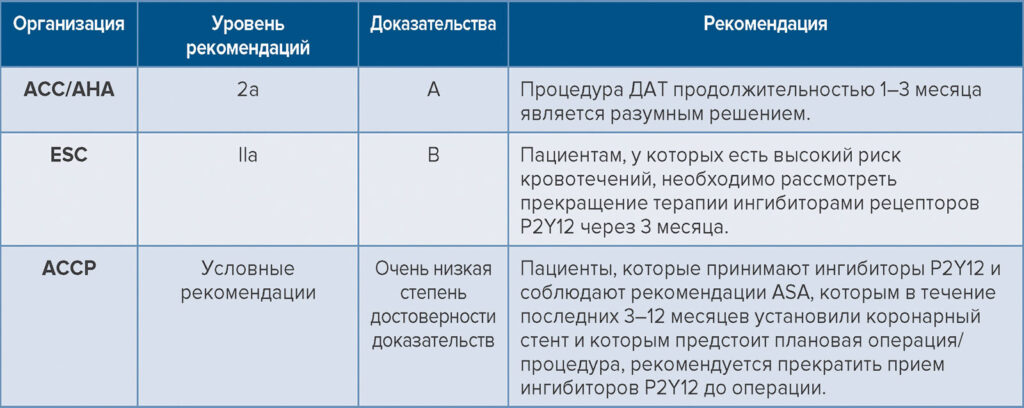
Согласно доступным и обновленным данным, представители Американской коллегии врачей-кардиологов (American College of Cardiology, ACC) и Американской кардиологической ассоциации (American Heart Association, AHA) предоставили рекомендации класса 2а (средние) в отношении сокращения продолжительности терапии ДАТ. Некоторые пациенты, которые проходят ЧКВ, могут безопасно изменить план лечения, а именно начать проходить монотерапию ингибиторами P2Y12 и отказаться от применения аспирина после прохождения терапии ДАТ на протяжении 1–3 месяцев. Однако это можно делать только в тех случаях, когда преимущества перевешивают риски.15
С другой стороны, представители Европейского общества кардиологов предлагают следующие рекомендации по продолжительности применения терапии ДАТ.16 После проведения ЧКВ при остром коронарном синдроме без подъема сегмента ST (NSTE-ACS), как правило, рекомендуют проходить терапию ДАТ с использованием мощного ингибитора P2Y12-рецепторов и аспирина в течение 12 месяцев, независимо от типа стента (если нет противопоказаний). Однако в конкретных клинических случаях, например при ВРК (на основании шкалы PRECISE-DAPT с показателями более 25 баллов или соответствия критериям ARC-HBR), врачи могут рассмотреть возможность сокращения продолжительности терапии ДАТ (до 12 месяцев), а также изменить схему лечения с учетом риска ишемии и кровотечения, возникновения неблагоприятных событий, сопутствующих заболеваний или препаратов, а также доступности лекарств. Кроме того, пациентам с NSTE-ACS и имплантацией стена, имеющих ВРК, необходимо рассмотреть прекращение терапии ингибиторами P2Y12-рецепторов через 3–6 месяцев. Для пациентов с очень высоким риском кровотечений, например при недавнем эпизоде кровотечения (за последние 30 дней) или предстоящем хирургическом вмешательстве, можно использовать схему приема аспирина и клопидогреля в течение 1 месяца.
В 2022 году представители Американской коллегии врачей пульмонологов предоставили обновленные рекомендации относительно сроков проведения ДАТ после установки стентов нового поколения с лекарственным покрытием.17 Они также составили условные советы для пациентов, которым установили стент в течение последних 3–12 месяцев, назначили плановую операцию и которые проходят терапию ДАТ. Рекомендуется прекратить прием ингибитора P2Y12 до операции. Согласно косвенным доказательствам и оценкам экспертов установлено, что прекращение приема такого вещества для пациентов с имплантированными более чем за 3 месяца до операции стентами является безопасным решением (см. табл. 3).
Таблица 3. Рекомендации по сокращению продолжительности ДАТ перед хирургическим вмешательством.
ЗАКЛЮЧЕНИЕ
После публикации Информационного бюллетеня APSF в 2009 году произошли изменения парадигм в сфере кардиологии в отношении продолжительности терапии ДАТ. Благодаря технологии стентов нового поколения пациенты реже сталкиваются с тромбозом стента, а врачи-кардиологи, в свою очередь, сократили рекомендуемую продолжительность терапии ДАТ для новых стентов с лекарственным покрытием до 1–3 месяцев курса антикоагуляции для пациентов со стабильной ишемической болезнью сердца. Поскольку новые стенты характеризуются улучшенными характеристиками, применение голых металлических стентов утратило свою актуальность. Они вышли из употребления и их не так часто используют. Кардиологи вместе с хирургами и анестезиологами должны принимать решения о продолжительности терапии ДАТ в условиях срочной операции. Они также могут назначать очень короткий курс ДАТ. Анестезиологи должны с осторожностью проводить сокращенную терапию ДАТ и помнить о том, что пациентам с недавно установленными стентами может быть рекомендована антикоагуляция продолжительностью всего 1 месяц, исходя из данных об улучшенном профиле безопасности таких стентов нового поколения.
Джанак Чандрасома (Janak Chandrasoma), дипломированный врач, является доцентом кафедры анестезиологии, Keck School of Medicine of USC, г. Лос-Анджелес, штат Калифорния, США.
Эбигейл Сонг (Abigail Song), бакалавр, является студентом 4 курса учреждения Keck School of Medicine of USC, г. Лос-Анджелес, штат Калифорния, США.
Джозеф В. Сокол (Joseph W. Szokol), дипломированный врач, является доцентом кафедры анестезиологии, Keck School of Medicine of USC, г. Лос-Анджелес, штат Калифорния, США.
Антреас Хиндоян (Antreas Hindoyan), дипломированный врач, доцент кафедры анестезиологии, Keck School of Medicine of USC, г. Лос-Анджелес, штат Калифорния, США.
Авторы заявили об отсутствии конфликта интересов.
СПИСОК ЛИТЕРАТУРЫ
- Greenberg SB, Matten EC, Murphy GM, Vender JS. Perioperative coronary stent thrombosis: a continuing safety concern. APSF Newsletter. 2009;24:17. https://www.apsf.org/article/perioperative-coronary-stent-thrombosis-
a-continuing-safety-concern/ Accessed August 8, 2024. - Tsimikas S. Drug-eluting stents and late adverse clinical outcomes: lessons learned, lessons awaited. J Am Coll Cardiol. 2006;47:2112–2115. PMID: 16697332
- Douketis JD, Berger PB, Dunn AS, et al. The perioperative management of antithrombotic therapy: American College of Chest Physicians Evidence-Based Clinical Practice Guidelines (8th Edition). Chest. 2008;133:299S–339S. PMID: 18574269
- Ueki Y, Bär S, Losdat S, et al. Validation of the Academic Research Consortium for High Bleeding Risk (ARC-HBR) criteria in patients undergoing percutaneous coronary intervention and comparison with contemporary bleeding risk scores. EuroIntervention. 2020;16:371–379. PMID: 32065586
- Capodanno D, Morice MC, Angiolillo DJ, et al. Trial design principles for patients at high bleeding risk undergoing PCI. JACC Scientific Expert Panel. J Am Coll Cardiol. 2020;76:1468–1483. PMID: 32943165
- PreciseDAPT Web calculator. PREdicting bleeding Complications In patients undergoing Stent implantation and subsEquent Dual Anti Platelet Therapy. http://www.precisedaptscore.com/predapt/ Accessed August 9, 2024.
- Pivato CA, Reimers B, Testa L, et al. One-month dual antiplatelet therapy after bioresorbable polymer everolimus-eluting stents in high bleeding risk patients. J Am Heart Assoc. 2022;11:e023454. PMID: 35114814
- Vranckx P, Valgimigli M, Jüni P, et al. Ticagrelor plus aspirin for 1 month, followed by ticagrelor monotherapy for 23 months vs aspirin plus clopidogrel or ticagrelor for 12 months, followed by aspirin monotherapy for 12 months after implantation of a drug-eluting stent: a multicentre, open-label, randomised superiority trial. Lancet. 2018;15;392:940–949. PMID: 30166073
- Mehran R, Baber U, Sharma SK, et al. Ticagrelor with or without aspirin in high-risk patients after PCI. N Engl J Med. 2019;381:2032–2042. PMID: 31556978
- Natsuaki M, Morimoto T, Yamamoto E, et al. One-year outcome of a prospective trial stopping dual antiplatelet therapy at 3 months after everolimus-eluting cobalt-chromium stent implantation: ShortT and OPtimal duration of Dual AntiPlatelet Therapy after everolimus-eluting cobalt-chromium stent (STOPDAPT) trial. Cardiovasc Interv Ther. 2016;31:196–209. PMID: 26518420
- Varenne O, Cook S, Sideris G, et al. Drug-eluting stents in elderly patients with coronary artery disease (SENIOR): a randomised single-blind trial. Lancet. 2018;39:41–50. PMID: 29102362
- Kirtane AJ, Stoler R, Feldman R, et al. Primary Results of the EVOLVE Short DAPT study evaluation of 3-month dual antiplatelet therapy in high bleeding risk patients treated with a bioabsorbable polymer-coated everolimus-eluting stent. Circ Cardiovasc Interv. 2021;14:e010144. PMID: 33641374
- Mehran R, Cao D, Angiolillo DJ, et al. 3- or 1-month DAPT in patients at high bleeding risk undergoing everolimus-eluting stent implantation. JACC Cardiovasc Interv. 2021;14:1870–1883. PMID: 34503737
- Watanabe H, Morimoto T, Natsuaki M, et al. Comparison of clopidogrel monotherapy after 1 to 2 months of dual antiplatelet therapy with 12 months of dual antiplatelet therapy in patients with acute coronary syndrome The STOPDAPT-2 ACS Randomized Clinical Trial). JAMA Cardiol. 2022;7:407–417. PMID: 35234821
- Lawton JS, Tamis-Holland JE, Bangalore S, et al. 2021 ACC/AHA/SCAI guideline for coronary artery revascularization: a report of the American College of Cardiology/American Heart Association Joint Committee on clinical practice guidelines. Circulation. 2022;145:e18–e114. PMID: 34882435
- Collet JP, Thiele H, Barbato E, et al. 2020 ESC Guidelines for the management of acute coronary syndromes in patients presenting without persistent ST-segment elevation. Eur Heart J. 2021;42:1289–1367. PMID: 32860058
- Douketis JD, Spyropoulos AC, Murad H, et al. Perioperative management of antithrombotic therapy: An American College of Chest Physicians clinical practice guideline. CHEST. 2022;162:e207–e243. PMID: 35964704


 Issue PDF
Issue PDF