Опиоид‑индуцированная дыхательная недостаточность может быть угрожающим для жизни, однако предотвратимым, осложнением у детей. Крайне важно выявить тех, кто подвержен риску развития опиоид‑индуцированной дыхательной недостаточности, и разработать более безопасные методы, включая использование вспомогательных препаратов, снижающих применение опиоидов, частую оценку седации и бдительный мониторинг. К сожалению, в настоящее время не существует моделей, позволяющих предсказать риск развития опиоид-индуцированной дыхательной недостаточности у детей, однако использование нескольких дополнительных мониторов может позволить снизить количество серьезных инцидентов, связанных с опиоидами.
 Дыхательная недостаточность после операции может быть вызвана целым рядом причин и привести к катастрофическим осложнениям1. Одной из повторяющихся причин является периоперационное использование опиоидов2. В свете этого, различные учреждения и профессиональные общества, в частности ассоциация Anesthesia Patient Safety Foundation (APSF), разработали рекомендации по мониторингу пациентов3,4 и опубликовали статьи, призывающие определять уровень послеоперационного мониторинга с помощью оценки факторов риска для каждого пациента5. Как и в случае со взрослыми, периоперационные дыхательные осложнения возникают у педиатрических пациентов, вызывая нежелательные явления после операции6. Однако дети — это не «маленькие взрослые». Поэтому следует с осторожностью опираться на ранее опубликованные рекомендации и исследования.
Дыхательная недостаточность после операции может быть вызвана целым рядом причин и привести к катастрофическим осложнениям1. Одной из повторяющихся причин является периоперационное использование опиоидов2. В свете этого, различные учреждения и профессиональные общества, в частности ассоциация Anesthesia Patient Safety Foundation (APSF), разработали рекомендации по мониторингу пациентов3,4 и опубликовали статьи, призывающие определять уровень послеоперационного мониторинга с помощью оценки факторов риска для каждого пациента5. Как и в случае со взрослыми, периоперационные дыхательные осложнения возникают у педиатрических пациентов, вызывая нежелательные явления после операции6. Однако дети — это не «маленькие взрослые». Поэтому следует с осторожностью опираться на ранее опубликованные рекомендации и исследования.
ПЕДИАТРИЧЕСКИЕ ФАКТОРЫ РИСКА ВОЗНИКНОВЕНИЯ ОПИОИД‑ИНДУЦИРОВАННОЙ ДЫХАТЕЛЬНОЙ НЕДОСТАТОЧНОСТИ
В настоящее время количество литературы, посвященной факторам риска возникновения опиоид‑индуцированной дыхательной недостаточности (Opioid‑Induced Respiratory Depression, OIRD) у детей, невелико. Значительными факторами риска для взрослых являются сахарный диабет и кардиологическое заболевание7,8, однако в связи с низкой частотой их возникновения у детей, они вряд ли являются основными для педиатрических пациентов. Вместо этого необходимые факторы риска удалось выявить в ходе аудита пациентов и отслеживания приема налоксона — косвенного показателя OIRD (рисунок 1). Например, наличие респираторного заболевания и задержка в развитии были признаны сопутствующими заболеваниями, которые могут увеличивать риск возникновения OIRD у детей9–11.
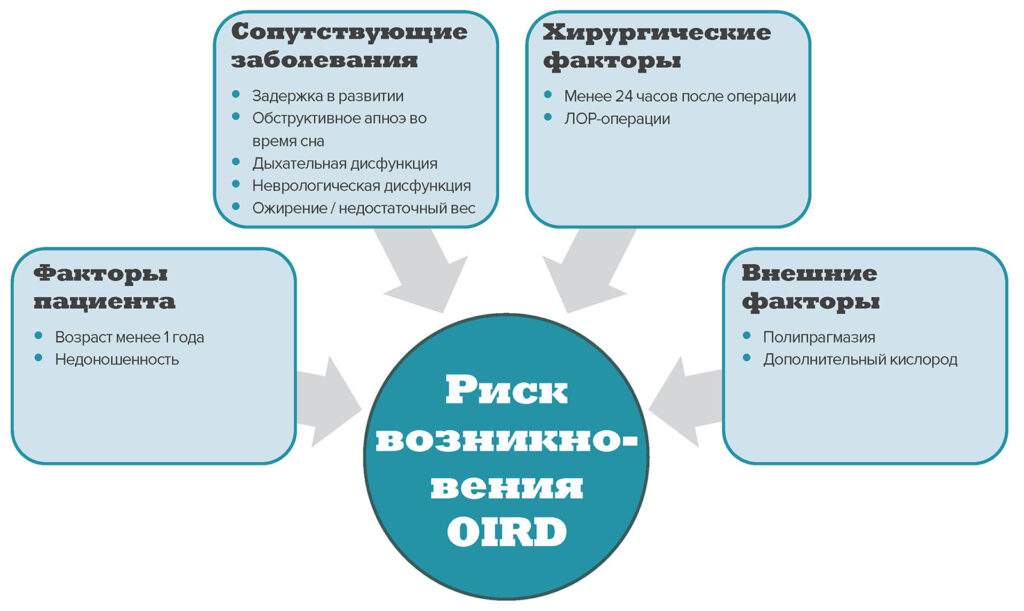
Рисунок 1. Краткий обзор факторов, связанных с повышенным риском возникновения опиоид‑индуцированной дыхательной недостаточности (OIRD) у детей4,10
Еще одним фактором риска является ранний возраст. В ретроспективном обзоре педиатрических пациентов, которым был применен налоксон для лечения критических респираторных состояний, увеличение частоты случаев было связано с более ранним возрастом, а также недоношенностью10. Повышенный риск может быть связан с физиологическими различиями метаболизма и выведения опиоидов у младенцев, детей старшего возраста и взрослых. Например, период полувыведения морфина удлинен, а клиренс ниже у новорожденных. Таким образом, в зависимости от дозировки, у младенцев в возрасте до одного месяца может быть достигнут более высокий уровень этого препарата в сыворотке, который снижается медленнее, чем у детей старшего возраста и взрослых, что подвергает их повышенному риску12.
О повышенном риске послеоперационной дыхательной недостаточности при обструктивном апноэ во время сна (ОАС)13 сообщается и у детей. После тонзиллэктомии дети с тяжелой формой ОАС более чувствительны к вызванной морфином дыхательной недостаточности и нуждаются в меньшем количестве морфина, чем дети с легкой формой апноэ во время сна14. ОАС относительно распространено в педиатрии, встречаясь у 1–5 % детей15. Однако предоперационный скрининг этого фактора может быть несколько затруднен. Золотым стандартом диагностики ОАС является полисомнография, однако она недоступна для большинства педиатрических пациентов. Не существует утвержденной анкеты для оценки рисков, применимой к детям всех возрастов; однако встречаются упоминания о педиатрических факторах риска и симптомах ОАС16.
Детское ожирение также является фактором риска введения налоксона10. Это может быть объяснено тесной связью ожирения и ОАС или указывать на неправильную дозировку из-за наличия ожирения. Дозирование по весу является обычной практикой для многих лекарств, назначаемых детям (в отличие от взрослых), однако дозирование опиатов по общей массе тела может вызвать опасную дыхательную недостаточность. Поэтому дозировку следует подбирать, основываясь на идеальной или мышечной массе тела17. Примечательно, что у детей недостаточный вес также является фактором риска развития респираторных осложнений10.
В большинстве случаев до наступления вызванной опиоидами заболеваемости у детей наблюдалась чрезмерная седация4. Хотя седативный эффект опиоидов у пациентов, не принимающих их ранее, хорошо известен, угнетение центральной нервной системы (ЦНС) может быть усугублено совместным приемом анксиолитиков, миорелаксантов, противосудорожных и других седативных препаратов. Такие комбинации могут привести к угрожающим жизни респираторным осложнениям и повышенному риску необходимости использования налоксона10. Это особенно важно, поскольку совместное применение опиоидов и других средств, угнетающих ЦНС, как сообщается, широко распространено в педиатрической практике: более 40 % респондентов допускают совместное назначение этих препаратов в ходе опроса 2010 года о практике лечения боли у педиатрических пациентов18. Невзирая на то, что за прошедшее десятилетие эта практика могла измениться, и учитывая, что в последнее время основное внимание уделяется экономии опиоидов при использовании мультимодальных анальгетических схем, такая полипрагмазия вряд ли значительно снизилась.
Риск возникновения дыхательной недостаточности является наибольшим в первый день после операции. Более того, 75 % эпизодов у детей, принимающих налоксон для лечения критических дыхательных расстройств, произошли в течение первых 24 часов после операции. Опиоиды были получены внутривенно, перорально и нейроаксиально, что говорит о том, что ни один из методов введения не является по своей сути безрисковым10.
ТЕКУЩИЕ РЕКОМЕНДАЦИИ ПО МОНИТОРИНГУ ПЕДИАТРИЧЕСКИХ ПАЦИЕНТОВ
Эксперты рекомендуют непрерывный мониторинг оксигенации и вентиляции педиатрических пациентов, получающих опиоиды, в течение как минимум 24 часов после операции
Чтобы минимизировать риск возникновения дыхательной недостаточности, APSF давно выступает за использование непрерывного электронного мониторинга оксигенации и вентиляции (когда предоставляется дополнительный кислород) для заблаговременного выявления и предотвращения OIRD3. Хотя исследования, специально дифференцирующие требования мониторинга для педиатрических пациентов, отсутствуют, консенсусное заявление, одобренное Обществом детской анестезии (Society for Pediatric Anesthesia), поддерживает повышенную бдительность при уходе за отдельными категориями пациентов, включая новорожденных, детей с ОАС и тех, у кого имеются сопутствующие нервно-мышечные заболевания либо когнитивные нарушения, которые могут повлиять на функцию дыхательных мышц и/или затруднить оценку уровня боли либо сознания пациента. Кроме того, соблюдать повышенную бдительность необходимо, если ребенку начинают опиоидную терапию, особенно в начальном послеоперационном периоде, назначают нарастающие дозы парентеральных опиоидов или опиоиды в сочетании с другими препаратами, угнетающими ЦНС4.
Эксперты поддерживают мониторинг педиатрических пациентов, получающих начальные дозы парентеральных опиоидов или опиоидов для контролируемой пациентом анальгезии (Patient-Controlled Analgesia, PCA), PCA по доверенности и/или постоянной инфузии, особенно рекомендуя непрерывный мониторинг частоты дыхания и пульсоксиметрии в течение первых 24 часов, если пациент не спит и активно наблюдается4,12. Предыдущие исследования поддерживают использование более частого непрерывного мониторинга у детей. В исследовании 2010 года, посвященном практике обезболивания в педиатрии, респонденты сообщили, что непрерывный мониторинг пульсоксиметрии является обычным явлением при предоставлении опиоидов методом PCA18. Однако непрерывный мониторинг частоты дыхания использовался менее последовательно (рисунок 2).
![Рисунок 2: Тип мониторинга, используемый при назначении опиоидов педиатрическим пациентам. (Общее число респондентов, ответивших на вопрос, — 149; общее число респондентов, проводивших внутривенную контролируемую пациентом внутривенную анальгезию [IVPCA] по доверенности, — 95.) Девяносто процентов респондентов сообщили об использовании пульсоксиметрии при PCA. Электрокардиографический мониторинг и капнография всегда использовались в сочетании с пульсоксиметрией, в то время как индуктивная дыхательная плетизмография (Respitrace) почти всегда проводилась в сочетании с пульсоксиметрией (> 90 %), но иногда применялась как единственный вид мониторинга<sup>17</sup>. Перепечатано с разрешения редакции журнала Anesthesia & Analgesia и исследования при поддержке компании Wolters Kluwer Health, Inc.: Нельсон К. Л. (Nelson KL), Ястер М. (Yaster M), Кост-Байерли С. (Kost-Byerly S), Монитто К. Л. (Monitto CL). A national survey of American Pediatric Anesthesiologists: patient-controlled analgesia and other intravenous opioid therapies in pediatric acute pain management. Anesth Analg. 2010;110:754–760.<sup>18</sup>](https://www.apsf.org/wp-content/uploads/newsletters/2024/0702-ru/figure2-monitoring-ru-1024x732.jpg)
Рисунок 2: Тип мониторинга, используемый при назначении опиоидов педиатрическим пациентам. (Общее число респондентов, ответивших на вопрос, — 149; общее число респондентов, проводивших внутривенную контролируемую пациентом внутривенную анальгезию [IVPCA] по доверенности, — 95.) Девяносто процентов респондентов сообщили об использовании пульсоксиметрии при PCA. Электрокардиографический мониторинг и капнография всегда использовались в сочетании с пульсоксиметрией, в то время как индуктивная дыхательная плетизмография (Respitrace) почти всегда проводилась в сочетании с пульсоксиметрией (> 90 %), но иногда применялась как единственный вид мониторинга17. Перепечатано с разрешения редакции журнала Anesthesia & Analgesia и исследования при поддержке компании Wolters Kluwer Health, Inc.: Нельсон К. Л. (Nelson KL), Ястер М. (Yaster M), Кост-Байерли С. (Kost-Byerly S), Монитто К. Л. (Monitto CL). A national survey of American Pediatric Anesthesiologists: patient-controlled analgesia and other intravenous opioid therapies in pediatric acute pain management. Anesth Analg. 2010;110:754–760.18
МОНИТОРИНГ РЕСПИРАТОРНЫХ ПОКАЗАТЕЛЕЙ У ПЕДИАТРИЧЕСКИХ ПАЦИЕНТОВ И СВЯЗАННЫЕ С НИМ ТРУДНОСТИ
Десатурация может быть поздним предупреждающим признаком дыхательной недостаточности, если пациент получает кислород
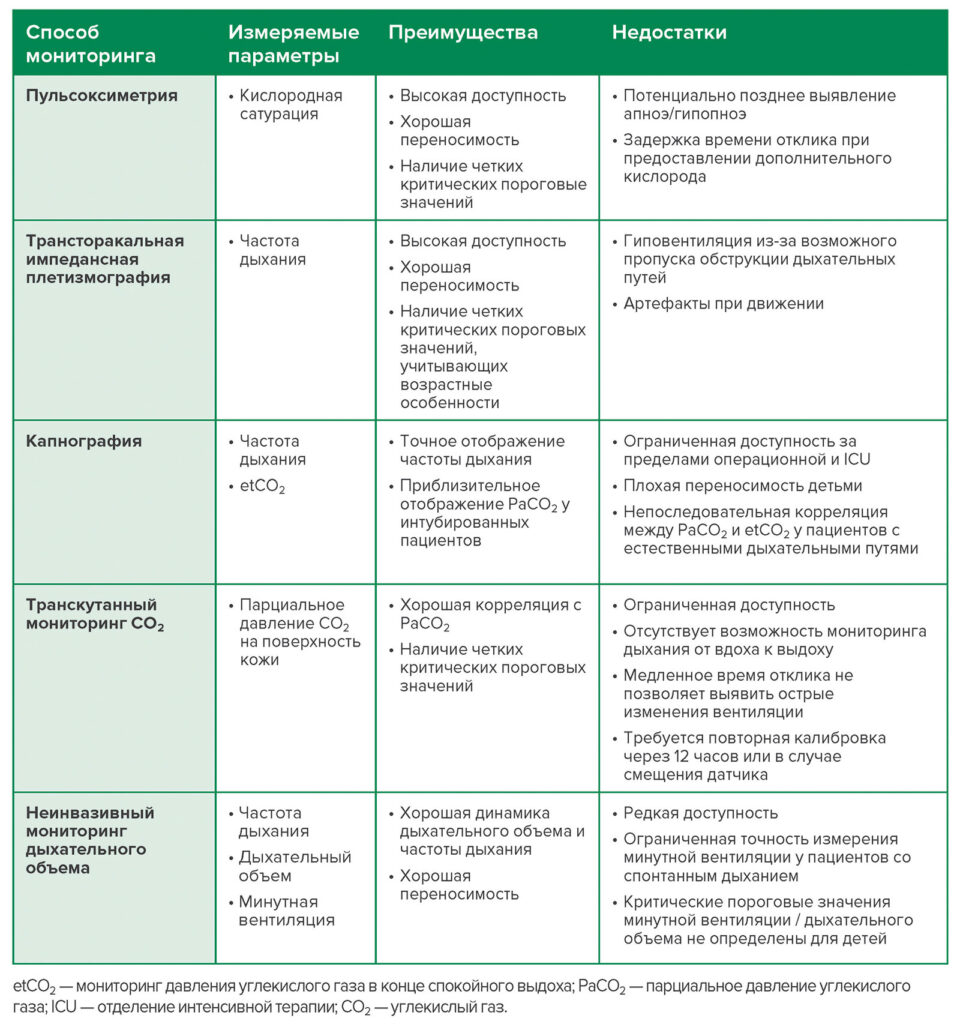
Как и в случае со взрослыми, мониторинг респираторных показателей должен заблаговременно определять OIRD, чтобы врачи могли вмешаться и не допустить возникновения критической ситуации. В идеале такой мониторинг должен непрерывно и точно измерять оксигенацию, частоту дыхания, напряжение углекислого газа (CO2), а также воздушный поток. В настоящее время существуют мониторы для отслеживания каждого параметра, однако все они имеют свои недостатки в качестве устройств, определяющих надвигающуюся дыхательную недостаточность (таблица 1).
Таблица 1. Краткий обзор методов респираторного мониторинга для выявления OIRD2,4,6,7,20–23.
Наиболее распространенными способами мониторинга являются непрерывная пульсоксиметрия и трансторакальная импедансная плетизмография. С момента появления в педиатрической практике в 1980 году пульсоксиметрия предоставляет крайне важную информацию об уровне оксигенации у младенцев и детей. Пульсоксиметры часто доступны в педиатрических палатах, и такой мониторинг хорошо переносится пациентами всех возрастов. Однако десатурация может быть поздним предупреждающим признаком дыхательной недостаточности, особенно если пациент получает дополнительный кислород4. Как показывают исследования, к сожалению, дополнительный кислород часто требуется после операций, независимо от сложности хирургического вмешательства, наличия сопутствующих заболеваний у пациента или введения анальгетиков11,18. Эта потребность создает повышенный риск нераспознанной гиповентиляции у детей, увеличивая промежуток времени между апноэ/гипопноэ и десатурацией.
Еще один часто доступный и хорошо переносимый способ — трансторакальная импедансная плетизмография, позволяющая определять апноэ и гипопноэ и отличительные признаки действия опиоидов на дыхательные центры. Однако использовать респираторные параметры, подходящие по возрасту, следует с осторожностью. К сожалению, мониторинг частоты дыхания с помощью этого метода может быть неточным из-за неоптимального размещения электродов ЭКГ, артефактов движения и физиологических явлений, вызывающих движение грудной стенки, таких как кашель и плач. Кроме того, он может не выявить дыхательную недостаточность в условиях недиагностированной обструкции дыхательных путей.
Измерение парциального давления углекислого газа в артериальной крови (PaCO2) — надежный способ оценить вентиляцию, однако он требует артериального доступа и не предназначен для непрерывного мониторинга. Неинвазивные способы измерения PaCO2, непрерывно предоставляющие данные, включают транскутанный мониторинг, а также мониторинг давления углекислого газа (PCO2) в конце спокойного выдоха (etCO2). Транскутанный мониторинг газов утратил популярность в 1980-х годах из-за технических сложностей, в частности риска ожогов кожи при использовании для новорожденных. Однако в настоящее время благодаря технологическим достижениям, транскутанный мониторинг PCO2 является клинически приемлемым и безопасным способом. Эффективность этого способа изучалась в педиатрических популяциях20, а не у младенцев, получающих опиодные препараты после операций. Несмотря на хорошую корреляцию со стабильным PaCO2, время отклика не позволяет быстро установить острые изменения вентиляции, что ограничивает его использование для раннего определения необходимых признаков.
Капнография должна использоваться, когда послеоперационные пациенты, получающие опиоиды, находятся на дополнительном кислороде
Другой вариант — мониторинг давления CO2 в конце спокойного выдоха (etCO2), обеспечивающий раннее и надежное предупреждение о вентиляционной недостаточности при использовании для наблюдения за интубированными, анестезированными или находящимися в глубокой седации пациентами. Капнография с назальным и оральным отбором проб была изучена у неинтубированных взрослых, получающих PCA2,7, и является более чувствительным индикатором дыхательной недостаточности, чем мониторинг сатурации, что подтверждает возможность ее применения в качестве раннего определения надвигающейся дыхательной недостаточности. В свете этих данных APSF рекомендовала использовать капнографию для мониторинга вентиляции послеоперационных пациентов, получающих опиоиды и дополнительный кислород. Однако для правильного применения капнографии требуется сотрудничество пациента при длительном ношении специально разработанной капнографической канюли, чтобы определять низкие объемы воздуха, выдыхаемого как через рот, так и через нос. Эти канюли могут быть неудобными или мешать таким видам деятельности, как прием пищи либо разговор, что влияет на переносимость пациентом. При исследовании у неинтубированных, послеоперационных педиатрических пациентов, не пребывающих под седацией, капнография, по сути, часто плохо переносилась именно по этим причинам, что ограничивает ее применение в педиатрическом мониторинге21.
Четкое понимание информации, получаемой при капнографическом мониторинге, имеет большое значение. Хотя капнография обеспечивает точное измерение частоты дыхания, значение показателей etCO2 может существенно отличаться у пациентов с естественными или искусственными дыхательными путями. Как было отмечено в исследовании PRODIGY, более чем у 60 % пациентов, находившихся под наблюдением, отмечались эпизоды уменьшения etCO2 ниже 15 мм рт. ст. (более 50 % — имели низкие etCO2 и частоту дыхания), но ни у одного пациента etCO2 не поднималось выше 60 мм рт. ст.7 Эти результаты позволяют предположить, что во многих случаях значения etCO2 не отражали PaCO2, а являлись косвенным показателем плохого воздушного потока из-за нераспознанной обструкции.
Новые технологии, такие как неинвазивный мониторинг дыхательного объема, могут обеспечить более чувствительную оценку воздушного потока, в частности дыхательного объема и минутной вентиляции. Такие способы мониторинга утверждены как для взрослых, так и для интубированных детей, пребывающих на искусственной вентиляции легких под общей анестезией6,22. Однако у взрослых со спонтанным дыханием дыхательный объем и частота дыхания имели хорошую динамику, но точность измерения минутной вентиляции была ограничена по сравнению с золотым стандартом — спирометрией23. Тем не менее, отслеживание тенденций, которые могут обеспечить эти устройства, может способствовать их включению в будущие стратегии мониторинга. Предварительные данные пилотного исследования у подростков, получавших опиоиды с помощью PCA после заднего спондилодеза (рисунок 3), свидетельствуют о переносимости способов мониторинга подростками (из личной корреспонденции К. Монитто), что предполагает возможность их использования в педиатрическом мониторинге. При этом критические пороговые значения вентиляции, которые можно было бы применить для прогнозирования надвигающейся или выявления текущей, но нераспознанной дыхательной недостаточности, у детей еще предстоит четко определить.
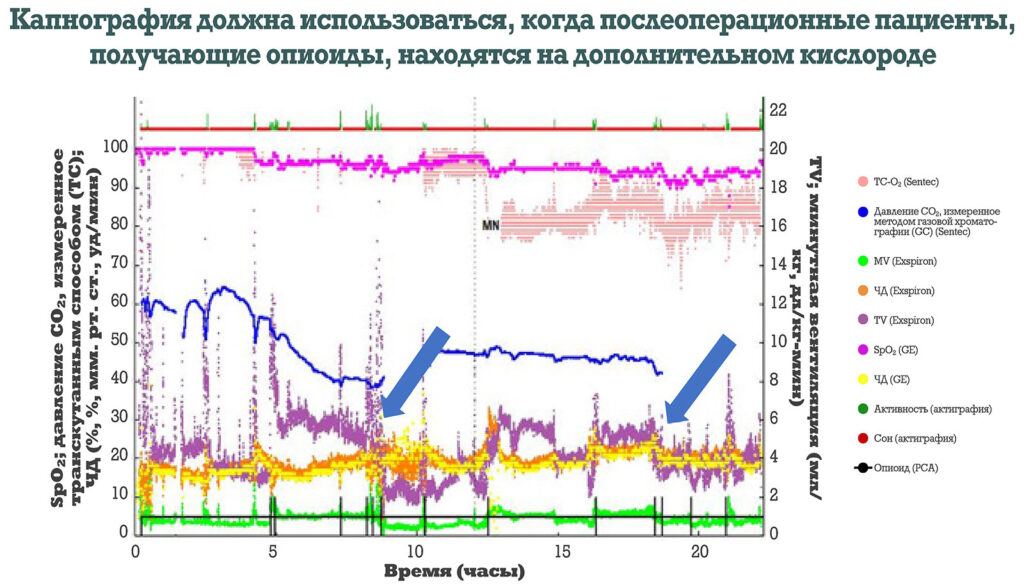
Рисунок 3: 24-часовой поток данных о насыщении кислородом, частоте дыхания (ЧД), давлении CO2, измеренным транскутанным способом, минутной вентиляции (МВ), дыхательном объеме, актиграфии и использовании опиоидов в рамках PCA у пациента-подростка после заднего спондилодеза. Снижение дыхательного объема (TV) после PCA (при болюсном введении) показано синими стрелками. MN означает «полуночь» (англ. — midnight). (Неопубликованные данные, полученные от Констанс Монитто.)
В заключение, пока не существует моделей прогнозирования риска вызванной опиоидами недостаточности дыхания у детей. При стратификации риска следует учитывать специфические для каждого пациента факторы, характерные только для детей, а не экстраполировать результаты исследований на взрослых. По имеющимся данным, непрерывный электронный мониторинг дыхания у детей используется чаще, чем при лечении взрослых, однако ни одна технология не обеспечивает комплексного решения для мониторинга детей с естественными дыхательными путями. В будущем использование нескольких дополнительных способов мониторинга в сочетании с парадигмами, разработанными с учетом специфических для педиатрии пороговых параметров тревоги, может позволить раньше выявлять эпизоды дыхательной недостаточности в этой уязвимой популяции.
Триша Веккионе, дипломированный врач, магистр общественного здравоохранения, является доцентом кафедры анестезиологии в Школе медицины при Университете Джонса Хопкинса (Johns Hopkins University School of Medicine), г. Балтимор, штат Мэриленд.
Констанс Л. Монитто, дипломированный врач, является ассистентом кафедры анестезиологии в Школе медицины при Университете Джонса Хопкинса, г. Балтимор, штат Мэриленд.
Авторы заявили об отсутствии конфликта интересов.
СПИСОК ЛИТЕРАТУРЫ
- Lee LA, Caplan RA, Stephens LS, et al. Postoperative opioid-induced respiratory depression: a closed claims analysis. Anesthesiology. 2015;122:659–665. PMID: 25536092.
- Overdyk FJ, Carter R, Maddox RR, et al. Continuous oximetry/capnometry monitoring reveals frequent desaturation and bradypnea during patient-controlled analgesia. Anesth Analg. 2007;105:412–418. PMID: 17646499.
- Weinger MB, Lee LA. “No patient shall be harmed by opioid-induced respiratory depression.” APSF Newsletter. 2011;26:21–40. https://www.apsf.org/article/no-patient-shall-be-harmed-by-opioid-induced-respiratory-depression/. Accessed February 28, 2024.
- Cravero JP, Agarwal R, Berde C, et al. The Society for Pediatric Anesthesia recommendations for the use of opioids in children during the perioperative period. Paediatr Anaesth. 2019;29:547–571. PMID: 30929307.
- Weingarten TN. Opioid-induced respiratory depression–beyond sleep disordered breathing. APSF Newsletter. 2023;38:2,42–45. https://www.apsf.org/article/opioid-induced-respiratory-depression-beyond-sleep-disordered-breathing/. Accessed February 28, 2024.
- Gomez-Morad AD, Cravero JP, Harvey BC, et al. The evaluation of a noninvasive respiratory volume monitor in pediatric patients undergoing general anesthesia. Anesth Analg. 2017;125:1913–1919. PMID: 28759491.
- Khanna AK, Bergese SD, Jungquist CR, et al. PRediction of Opioid-induced respiratory Depression In patients monitored by capnoGraphY (PRODIGY) group collaborators. prediction of opioid-induced respiratory depression on inpatient wards using continuous capnography and oximetry: an international prospective, observational trial. Anesth Analg. 2020;131:1012–1024. PMID: 32925318.
- Ramachandran SK, Haider N, Saran KA, et al. Life threatening critical respiratory events: a retrospective study of postoperative patients found unresponsive during analgesic therapy. J Clin Anesth. 2011;23:207–213. PMID: 21570616.
- Morton NS, Errera A. APA national audit of pediatric opioid infusions. Paediatr Anaesth. 2010;20:119–125. PMID: 19889193.
- Chidambaran V, Olbrecht V, Hossain M, et al. Risk predictors of opioid-induced critical respiratory events in children: naloxone use as a quality measure of opioid safety. Pain Med. 2014;15:2139–2149. PMID: 25319840.
- Voepel-Lewis T, Marinkovic A, Kostrzewa A, et al. The prevalence of and risk factors for adverse events in children receiving patient-controlled analgesia by proxy or patient-controlled analgesia after surgery. Anesth Analg. 2008; 107:70–75. PMID: 18635469.
- Monitto CL, George JA, Yaster M: Pediatric acute pain management. In: Davis PJ, Cladis FP (eds). Smith’s anesthesia for infants and children. 10th edition. Elsevier, Philadelphia, PA, 481–518, 2022.
- Chung F, Liao P, Elsaid H, et al. Factors associated with postoperative exacerbation of sleep-disordered breathing. Anesthesiology. 2014;120:299–311. PMID: 24158050.
- Brown KA, Laferriere A, Moss IR. Recurrent hypoxemia in young children with obstructive sleep apnea is associated with reduced opioid requirement for analgesia. Anesthesiology. 2004;100:806–810. PMID: 15087614.
- Marcus CL, Brooks LJ, Draper KA, et al. Diagnosis and management of childhood obstructive sleep apnea syndrome. Pediatrics. 2012;130:576–584. PMID: 22926173.
- Coté CJ, Posner KL, Domino KB. Death or neurologic injury after tonsillectomy in children with a focus on obstructive sleep apnea: Houston, we have a problem! Anesth Analg. 2014;118:1276–1283. PMID: 23842193.
- Mortensen A, Lenz K, Abildstrom H, Lauritsen TL. Anesthetizing the obese child. Paediatr Anaesth. 2011;21:623–629. PMID: 21429056.
- Nelson KL, Yaster M, Kost-Byerly S, Monitto CL. A national survey of American pediatric anesthesiologists: patient-controlled analgesia and other intravenous opioid therapies in pediatric acute pain management. Anesth Analg. 2010;110:754–760. PMID: 20185654.
- Quinlan-Colwell A, Thear G, Miller-Baldwin E, Smith A. Use of the Pasero Opioid-induced Sedation Scale (POSS) in pediatric patients. J Pediatr Nurs. 2017;33:83–87. PMID: 28209260.
- Berkenbosch JW, Tobias JD. Transcutaneous carbon dioxide monitoring during high-frequency oscillatory ventilation in infants and children. Crit Care Med. 2002;30:1024–1027. PMID: 12006797.
- Miller KM, Kim AY, Yaster M, et al. Long-term tolerability of capnography and respiratory inductance plethysmography for respiratory monitoring in pediatric patients treated with patient-controlled analgesia. Paediatr Anaesth. 2015; 25:1054–1059. PMID: 26040512.
- Atkinson DB, Sens BA, Bernier RS, et al. The evaluation of a noninvasive respiratory volume monitor in mechanically ventilated neonates and infants. Anesth Analg. 2022; 134:141–148. PMID: 33929346.
- Gatti S, Rezoagli E, Madotto F, et al. A non-invasive continuous and real-time volumetric monitoring in spontaneous breathing subjects based on bioimpedance-ExSpiron®Xi: a validation study in healthy volunteers. J Clin Monit Comput. 2024;38:539–551. PMID: 38238635.


 Issue PDF
Issue PDF