Комитет Committee on Practice Parameters (CPP) общества American Society of Anesthesiologists (ASA) под председательством Karen Domino, MD, MPH, создал целевую группу для разработки рекомендаций по нейромышечной блокаде (НМБ) с целью повышения безопасности и удовлетворенности пациентов. Ассоциация Anesthesia Patient Safety Foundation (APSF) и ее руководство давно выступают за разработку рекомендаций по использованию НМБ, ее мониторингу и отмене, учитывая риск для безопасности пациентов, связанный с остаточной мышечной слабостью. Целевая группа под сопредседательством Stephan Thilen, MD, MS, и Wade Weigel, MD, разработала практические рекомендации ASA 2023 г. по мониторингу и ингибированию нервно-мышечной блокады, которые были опубликованы в январском номере журнала Anesthesiology.1 В этой статье будет представлен обзор новых рекомендаций.a
aОтказ от ответственности: Практические рекомендации ASA направлены на улучшение лечения пациентов, повышение безопасности и улучшение результатов лечения путем предоставления актуальной информации для лечения пациентов. Практические рекомендации будут пересматриваться по мере появления новых медицинских знаний, технологий и практик. Практические рекомендации не предназначены для использования в качестве стандартов или абсолютных требований, заменяющих местную институциональную политику, и их использование не может гарантировать какой-либо конкретный результат.1
Практические рекомендации включают в себя восемь рекомендаций, касающихся типа мониторинга нервно-мышечной блокады, места проведения мониторинга и лекарственных препаратов, используемых для достижения надлежащей реверсии нервно-мышечной блокады. Шесть рекомендаций (1–6) были классифицированы как строгие рекомендации с умеренной весомостью доказательств. Две оставшиеся рекомендации (7–8) были классифицированы как условные рекомендации с низкой и очень низкой весомостью доказательств, соответственно.
Нервно-мышечные блокаторы широко используются, и, согласно литературным данным, при их применении частота остаточной блокады в конце операции и (или) в палате послеоперационного наблюдения (PACU) может достигать 64 %.2, 3 Остаточная блокада связана с многочисленными осложнениями, такими как обструкция верхних дыхательных путей, реинтубация, ателектаз, пневмония, длительное пребывание в PACU и снижение удовлетворенности пациентов.4–7
Количественную оценку нервно-мышечной блокады можно проводить с помощью стимуляторов периферических нервов, подающих четыре коротких электрических импульса. Амплитуда четвертого сокращения, разделенная на амплитуду первого подергивания, дает отношение TOF (четырехкратная пакетная стимуляция). Базовое отношение TOF у непарализованного пациента должно быть равно 1,0, что указывает на равную амплитуду всех четырех сокращений. Чем меньше отношение TOF, тем больше степень паралича. Существует широкий консенсус, что приемлемое восстановление нервно-мышечной функции определяется как отношение TOF больше или равно 0,9.1 Однако, несмотря на многочисленные исследования, в которых сообщалось о значительных преимуществах количественного мониторинга нервно-мышечной блокады, он не получил широкого распространения среди всех специалистов-анестезиологов.1 В международном исследовании 2019 г. было установлено несколько факторов, которые способствовали медленному внедрению количественного мониторинга: чрезмерная уверенность анестезиологов в оценке глубины нервно-мышечной блокады, недооценка частоты остаточной нервно-мышечной блокады и ее клинических последствий, а также отсутствие коммерчески доступных TOF-мониторов для проведения количественной оценки, удобных в использовании и недорогих.8
Анестезиологи чаще используют качественную оценку нервно-мышечной блокады.1 После стимуляции периферического нерва проводится визуальный осмотр или ручная (тактильная) оценка для субъективной оценки движения большого пальца, на основании чего определяется TOF-счет. Однако исследования показали, что клинически значимую слабость невозможно выявить с помощью этого метода, так как угасание не может быть достоверно оценено, пока отношение TOF не станет меньше примерно 0,4.9 Другим распространенным подходом является субъективная оценка устойчивого подъема головы или силы захвата. Однако исследования также показали, что эти приемы недостаточно чувствительны для выявления остаточной нервно-мышечной блокады, поскольку 80 % пациентов с отношением TOF < 0,7 могут выполнить подъем головы.10.
Более того, продолжительность действия нервно-мышечных блокаторов имеет большую межиндивидуальную ую вариабельность, и невозможно использовать временные интервалы для прогнозирования момента регрессии блока до определенной глубины. В практических рекомендациях цитируются 11 исследований, которые были объединены и проанализированы, в результате чего сообщалось о более низкой частоте остаточной нервно-мышечной блокады при количественном мониторинге по сравнению с качественной или клинической оценкой (дополнительные таблицы S8 и S9 (примечание: при переходе по ссылке загружается документ Word в формате doc), https://links.lww.com/ALN/C928).1 Поэтому при введении нервно-мышечных блокаторов, чтобы избежать остаточной нервно-мышечной блокады, не рекомендуется проводить только клиническую оценку (рекомендация 1), а вместо качественной оценки для снижения риска остаточной нервно-мышечной блокады рекомендуется количественный мониторинг (рекомендация 2).1
Остаточная нервно-мышечная блокада первоначально определялась как отношение TOF менее 0,7, на основании более ранних работ, показавших, что при таком отношении жизненная емкость и сила вдоха восстанавливались почти до нормы,11 но многочисленные более поздние исследования показали, что при отношении TOF менее 0,9 у пациентов наблюдаются клинические симптомы слабости.12 Как уже упоминалось, в практических рекомендациях советуют использовать количественный мониторинг TOF, а особо рекомендуется подтверждать отношение TOF больше или равное 0,9 перед экстубацией, поскольку в этом случае снижается частота остаточной нервно-мышечной блокады по сравнению с теми случаями, когда восстановление отношения TOF до этого уровня не было подтверждено (рекомендация 3).1
Следует отметить, что существуют различные типы TOF-мониторов для проведения количественной оценки, такие как акселеромиография, электромиография, кинемиография и механомиография. В рекомендации были включены две дополнительные таблицы, в которых обобщены данные за последние 30 лет, касающиеся согласованности между технологиями (смещения) в виде различий TOF при заданном отношении TOF (дополнительная таблица 24 (примечание: при переходе по ссылке загружается документ Word в формате doc), https://links.lww.com/ALN/C928) и в виде времени для достижения заданного отношения TOF (дополнительная таблица 26 (примечание: при переходе по ссылке загружается документ Word в формате doc), https://links.lww.com/ALN/C928). Эти данные указывают на наличие различий между технологиями (обсуждение которых выходит за рамки данной статьи), однако в рекомендациях говорится, что предпочтительного типа монитора для количественной оценки нейромышечной блокады нет.1
В практических рекомендациях говорится, что приемлемое восстановление всех мышц после нервно-мышечной блокады оптимизирует безопасность пациента, и поэтому измерения «должны быть получены в местах с более длительным временем восстановления».1 Исследования показали, что мышцы глаза (corrugator supercilii и orbicularis oculi) относительно устойчивы к действию нервно-мышечных блокаторов по сравнению с adductor pollicis.1 В связи с этим время достижения отношения TOF, большего или равного 0,9, в adductor pollicis было больше, чем время достижения этого порога в мышцах глаза (дополнительные таблицы S15 и S16 (примечание: при переходе по ссылке загружается документ Word в формате doc), https://links.lww.com/ALN/C928).1 Поэтому для нейромышечного мониторинга рекомендуется использовать adductor pollicis (рекомендация 4) и избегать использование глазных мышц для нейромышечного мониторинга (рекомендация 5).1 В руководстве также указано, что если интраоперационный нейромышечный мониторинг проводился на глазных мышцах, потому что другой участок не был легко доступен в интраоперационных условиях, то рекомендуется сменить участок на adductor pollicis до начала реверсии.1
Эффективность фармакологической реверсии нервно-мышечной блокады зависит от глубины блокады. В практических рекомендациях используется та же схема классификации различной глубины блокады, которая представлена в Консенсусном заявлении 2018 г. об использовании нейромышечного мониторинга в периоперационный период (таблица 1).1, 13 Индуцированную аминостероидами нейромышечную блокаду можно снять двумя способами. Антихолинэстеразы ингибируют ацетилхолинэстеразу и бутирилхолинэстеразу, продлевая присутствие ацетилхолина в нервно-мышечном соединении. Неостигмин был единственным антихолинэстеразным препаратом, который оценивался в практических рекомендациях, поскольку эдрофоний больше не доступен в США. Сугаммадекс является селективным релаксант-связывающим препаратом, и его можно использовать для снятия любой глубины блока, индуцированного рокуронием или векуронием. Он более эффективен, чем неостигмин, для снятия глубокого, умеренного и легкого уровней блокады и рекомендуется для устранения нервно-мышечной блокады любой глубины (рекомендация 6).1 Одобренная FDA дозировка сугаммадекса для ингибирования действия рокурония или векурония составляет 2 мг/кг при значении TOF-счета = 2 и отношении TOF < 0,9, 4 мг/кг при значении посттетанического счета = 1 и значении TOF-счета = 1 и 16 мг/кг для немедленного ингибирования после введения одной дозы рокурония 1,2 мг/кг.14
Таблица 1. Оценка глубины нервно-мышечной блокады с использованием количественных и качественных методов измерений.
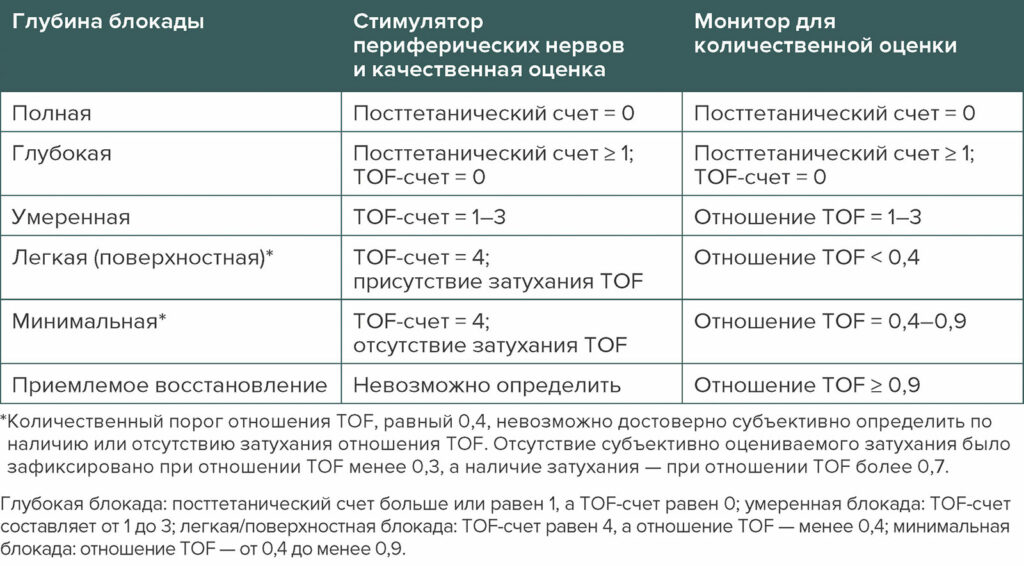
Таблица 5 из Практических рекомендаций ASA 2023 г. по мониторингу и антагонизму нейромышечной блокады: A Report by American Society of Anesthesiologists Task Force on Neuromuscular Blockade.1 Перепечатано и изменено с разрешения Wolters Kluwer Health, Inc.
Неостигмин эффективен для снятия минимального блока (отношение TOF ≥ 0,4 и < 0,9) и рекомендован как разумная альтернатива сугаммадексу для устранения минимального блока (рекомендация 7).1 Если неостигмин используется для устранения блока, который глубже минимальной блокады, степень антагонизма будет варьироваться между пациентами. При использовании качественной оценки невозможно определить, когда будет достигнуто восстановление до отношения TOF ≥ 0,9. В руководстве есть комментарий по этой ситуации: «В зависимости от клинической оценки и в контексте количественного мониторинга неостигмин можно рассматривать для использования при глубине блока более минимальной (отношение TOF от 0,4 до 0,9), учитывая, что более глубокие блоки потребуют больше времени для достижения отношения TOF больше или равно 0,9».1
Исследования, в которых изучались побочные эффекты сугаммадекса и неостигмина (при совместном назначении с гликопирролатом), не свидетельствуют в пользу какого-либо одного препарата. В практических рекомендациях цитируется более 75 исследований, которые не выявили разницы между сугаммадексом и неостигмином с точки зрения частоты легочных осложнений, анафилаксии, брадикардии или тахикардии (при назначении с гликопирролатом), только послеоперационной тошноты и послеоперационной рвоты.
Действие нервно-мышечных блокаторов на основе бензилизохинолина, таких как атракурий и цисатракурий, можно снять только ингибиторами ацетилхолинэстеразы. Максимальный антагонистический эффект неостигмина, наиболее часто используемого ингибитора ацетилхолинэстеразы, достигается в течение 10 минут.15 Более того, эффективность неостигмина значительно выше при антагонизме минимальной блокады по сравнению с более глубокими уровнями блокады. Поэтому в рекомендации 8 говорится, что во избежание остаточной нервно-мышечной блокады при использовании качественной оценки снятие блокады, индуцированной цисатракурием или атракурием, не следует начинать до отсутствия субъективно оцениваемого угасания в реакции «четырехкратной пакетной стимуляции», и от момента снятия блокады неостигмином до экстубации должно пройти не менее 10 минут.1 При использовании количественного мониторинга экстубацию можно проводить сразу после подтверждения отношения TOF, больше или равного 0,9.
РЕЗЮМЕ РЕКОМЕНДАЦИЙ1
- При назначении нервно-мышечных блокаторов, чтобы избежать остаточной нервно-мышечной блокады, не рекомендуется проводить только клиническую оценку из-за нечувствительности данного метода оценки.1
- Чтобы избежать остаточной нервно-мышечной блокады, рекомендуется проведение количественного мониторинга вместо качественной оценки.
- При использовании количественного мониторинга перед экстубацией рекомендуется проверить, что значение отношения TOF превышает или равно 0,9.
- Для нейромышечного мониторинга мы рекомендуем использовать мышцу adductor pollicis.
- Для нейромышечного мониторинга не рекомендуется использовать глазные мышцы.
- При глубокой, умеренной и поверхностной глубине нервно-мышечной блокады, индицированной рокуронием или векуронием, чтобы избежать остаточной нервно-мышечной блокады, рекомендуется использовать сугаммадекс вместо неостигмина.
- Мы предлагаем неостигмин в качестве разумной альтернативы сугаммадексу при минимальной глубине нервно-мышечной блокады.
- Чтобы избежать остаточной нервно-мышечной блокады при введении атракурия или цисатракурия и использовании качественной оценки, при минимальной глубине нервно-мышечной блокады для реверсии блокады предлагается использовать неостигмин. При отсутствии количественного мониторинга с момента введения препарата для снятия блокады до экстубации должно пройти не менее 10 минут. При использовании количественного мониторинга экстубация может быть проведена сразу после подтверждения того, что значение отношения TOF превышает или равно 0,9.
ЗАКЛЮЧЕНИЕ
Остаточная нервно-мышечная блокада является важной проблемой безопасности пациентов, и в недавно опубликованных практических рекомендациях представлены восемь рекомендаций по мониторингу и снятию нервно-мышечной блокады в США, которые подтверждаются данными литературы. Количественный мониторинг нервно-мышечной блокады рекомендуется проводить на мышце adductor pollicis для подтверждения отношения TOF, большего или равного 0,9, перед экстубацией в комбинации с применением сугаммадекса или неостигмина для снятия блокады. Учитывая, что количественный мониторинг в условиях реальной клинической практики может быть доступен не повсеместно, качественный мониторинг TOF-счета может определять дозировку и время введения препаратов, устраняющих эффект миорелаксантов.
Connie Chung, MD, является доцентом кафедры анестезиологии в USC Keck School of Medicine, Los Angeles, CA.
Joseph Szokol, MD, JD, MBA, является профессором анестезиологии в USC Keck School of Medicine, Los Angeles, CA.
Wade A. Weigel, MD, является анестезиологом в Virginia Mason Medical Center, Seattle, WA.
Stephan R. Thilen, MD, MS, является адъюнкт-профессором анестезиологии в University of Washington, Seattle, WA.
Авторы заявили об отсутствии конфликта интересов.
СПИСОК ЛИТЕРАТУРЫ
- Thilen SR, Weigel WA, Todd MM, et al. 2023 American Society of Anesthesiologists practice guidelines for monitoring and antagonism of neuromuscular blockade: a report by the American Society of Anesthesiologists Task Force on Neuromuscular Blockade. Anesthesiology. 2023; 138:13–41. PMID: 36520073
- Fortier LP, McKeen D, Turner K, et al. The RECITE Study: A Canadian prospective, multicenter study of the incidence and severity of residual neuromuscular blockade. Anesth Analg. 2015;121:366–372. PMID: 25902322
- Saager L, Maiese EM, Bash LD, et al. Incidence, risk factors, and consequences of residual neuromuscular block in the United States: the prospective, observational, multicenter RECITE-US study. J Clin Anesth. 2019;55:33–41. PMID: 30594097
- Berg H, Roed J, Viby-Mogensen J, et al. Residual neuromuscular block is a risk factor for postoperative pulmonary complications. A prospective, randomised, and blinded study of postoperative pulmonary complications after atracurium, vecuronium and pancuronium. Acta Anaesthesiol Scand. 1997;41:1095–1103. PMID: 9366929
- Plaud B, Debaene B, Donati F, Marty J. Residual paralysis after emergence from anesthesia. Anesthesiology. 2010;112:1013–1022. PMID: 20234315
- Butterly A, Bittner EA, George E, et al. Postoperative residual curarization from intermediate-acting neuromuscular blocking agents delays recovery room discharge. Br J Anaesth. 2010;105:304–309. PMID: 20576632
- Murphy GS, Szokol JW, Avram MJ, et al. Intraoperative acceleromyography monitoring reduces symptoms of muscle weakness and improves quality of recovery in the early postoperative period. Anesthesiology. 2011;115:946–54. PMID: 21946094
- Naguib M, Brull SJ, Hunter JM, et al. Anesthesiologists’ overconfidence in their perceived knowledge of neuromuscular monitoring and its relevance to all aspects of medical practice: an international survey. Anesth Analg. 2019;128:1118–1126. PMID: 31094776
- Viby-Mogensen J, Jensen NH, Engbaek J, et al. Tactile and visual evaluation of the response to train-of-four nerve stimulation. Anesthesiology. 1985;63:440–443. PMID: 4037404
- Debaene B, Plaud B, Dilly MP, Donati F. Residual paralysis in the PACU after a single intubating dose of nondepolarizing muscle relaxant with an intermediate duration of action. Anesthesiology. 2003;98:1042–1048. PMID: 12717123
- Ali HH, Wilson RS, Savarese JJ, Kitz RJ. The effect of tubocurarine on indirectly elicited train-of-four muscle response and respiratory measurements in humans. Br J Anaesth. 1975;47:570–574. PMID: 1138775
- Kopman AF, Yee PS, Neuman GG. Relationship of the train-of-four fade ratio to clinical signs and symptoms of residual paralysis in awake volunteers. Anesthesiology. 1997; 86:765–771. PMID: 9105219
- Naguib M, Brull SJ, Kopman AF, et al. Consensus statement on perioperative use of neuromuscular monitoring. Anesth Analg. 2018;127:71–80. PMID: 29200077
- FDA Prescribing information for sugammadex. https://www.accessdata.fda.gov/drugsatfda_docs/label/2015/022225lbl.pdf Accessed on April 10, 2023.
- Miller R, Van Nyhuis L, Eger EI, et al. Comparative times to peak effect and durations of action of neostigmine and pyridostigmine. Anesthesiology. 1974;41:27–33. PMID: 4834375


 Issue PDF
Issue PDF