引言
国际标准化组织 (International Organization for Standardization, ISO) 成立于 1947 年,是联合国的一个非政府组织,旨在振兴二战后的全球经济。ISO 主要致力于工业产品和生产工艺的标准化,以促进国际贸易。参与和投票权按国家/地区分列,但实施则为全球性,每个国家/地区汇总意见的方式各不相同。
ISO 标准主要由生产商制定,但在医疗器械等行业,医疗照护专业人士的各类意见至关重要。生产商在生产工艺和监管合规性方面具备专业知识,因此在制定标准时往往发挥主导作用。然而,如果不充分考虑临床专家的意见,标准就有可能无法完全解决医务人员的临床需求和安全问题。
与一般工业设备不同,许多临床医疗器械更加强调的是如何使用,而不是技术规格。作为医疗器械操作者的临床医生责任重大,他们必须对患者的生命负全责,认识到这一点十分重要。
尽管通过技术委员会 (Technical Committees) 努力整合医学专家的意见,但临床医生在某些领域的参与仍较为有限,技术改进往往由生产商推动。
ISO 80369
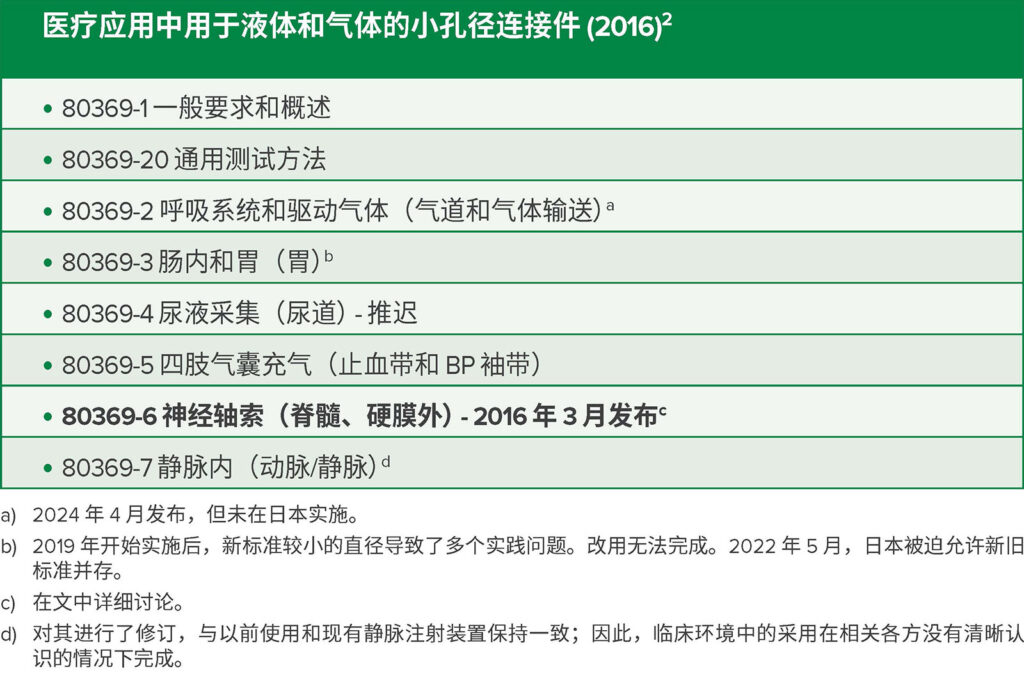
国际上对医疗安全的认识日益提高,促使 ISO 通过为肠内、呼吸、泌尿、血压、神经轴和静脉内患者照护系统制定独特的连接件设计标准,来解决因误连和给药不当造成的医疗事故。1,2ISO 于 2016 年开始发布 ISO 80369 系列标准。2鼓励参与国家/地区迅速采用这些国际标准(表 1、图 1)。
表 1:ISO 80369:
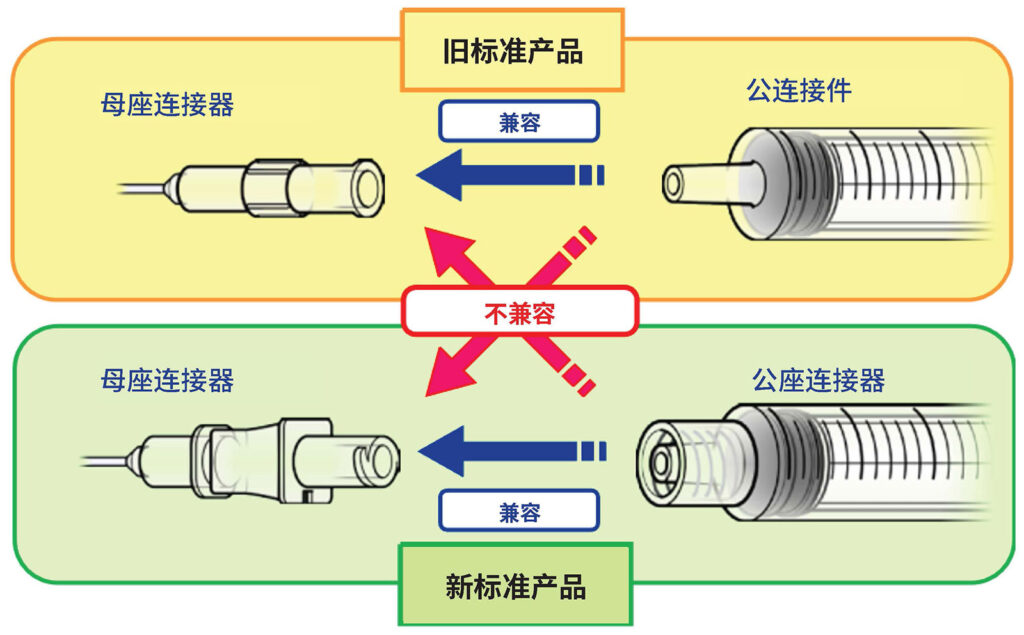
图 1:旧标准(鲁尔)连接件和新标准 (ISO 80369-6) 连接件。
PMDA 医疗安全信息,2018 年 8 月第 55 号,新旧标准产品的连接 http://www.pmda.go.jp/english/safety/info-services/safety-information/0001.html
日本获悉 ISO 80369-6 已在全球范围内(包括美国的部分地区)开始推广的信息(来源未知)后,并在政府的领导下于全国范围内引入 ISO 80369-6(神经轴索应用连接件)。这一过渡现已接近完成,虽然在过渡过程中未发生涉及生命损失的重大事故,但也出现了许多严重问题。据我们所知,还没有其他国家/地区完全改用这一新标准,因此日本的经验可以提高各方对可能发生的相关问题的认识,为全球患者安全做出贡献。
神经轴索应用连接件需要新标准 (ISO 80369-6)
 多年来,在临床实践中,鲁尔接头 (ISO-594) 一直是注射和连接小直径管路的标准。医务人员受益于其广泛连接提供的便利。然而,防止因鲁尔接头误连导致的意外注射完全依赖于相关医务人员的警惕度和责任感。
多年来,在临床实践中,鲁尔接头 (ISO-594) 一直是注射和连接小直径管路的标准。医务人员受益于其广泛连接提供的便利。然而,防止因鲁尔接头误连导致的意外注射完全依赖于相关医务人员的警惕度和责任感。
因此,人为错误(导致患者受伤的不可避免的原因)导致了许多类型的医疗设备误连。1 关于 ISO 80369 系列标准的讨论大致始于 2005 年,目标是利用特定于每种应用的物理非交互机制,开发特定用途的连接,以确保消除误连的可能性。
ISO 在技术委员会 210(TC 210,质量管理)中通过联合工作组 4 与 TC 121 联络,讨论了防止误连的专用兼容性标准(ISO 80369 系列)。TC 210 涵盖更广泛的主题,不一定是以麻醉为重点的 TC,尤其是与众多杰出麻醉医师参与的 TC 121 相比。在 TC 210 下成立了一个联合工作组,以传达 TC 121 对此事项的意见,但该工作组未发挥预期作用。
麻醉医师从早期开始就积极参与,为麻醉和重症监护领域做出了重大贡献。TC 121 设有 SC-3(小组委员会),负责管理麻醉医师直接处理的产品,如呼吸机、氧气浓缩器和相关患者监护仪。
日本实施 ISO 80369-6 的决策过程
在日本,实施体系基本上与 ISO 成立时的体系保持不变。影响人类生命的医疗器械的主要监督机构是日本厚生劳动省 (Ministry of Health, Labour, and Welfare, MHLW),该机构还拥有许可权。然而,负责监管一般行业的经济产业省 (Ministry of Economy, Trade and Industry, METI) 与 ISO 保持联系。在实践中,信息从 METI 流向 MHLW。因此,该过程缺乏监督和国内外临床医生的积极参与。
2015 年,MHLW 安全卫生部与一些医疗照护代表首次讨论 ISO 80369 的实施时,已假定要改用 ISO 80369-6。当时,麻醉医师对改用可能造成的混淆表示担忧,但在实践中,并未召开涉及临床医生或日本麻醉医师协会 (Japanese Society of Anesthesiologists, JSA) 的会议。引入程序和截止日期由 MHLW 和行业组织 MTJAPAN 确定。厚生劳动省解释称,日本作为世界贸易组织的成员,有遵守或协调 ISO 标准的基本义务。3 尽管确实存在例外情况,但日本必须在新标准发布后立即采用 ISO 标准作为国家标准,且不允许做出会造成国际贸易壁垒的变更。
虽然在实施 ISO 标准之前,必须仔细考虑临床环境中的风险-获益平衡,但日本并没有可以考虑这些因素的组织或机会。
MHLW 于 2017 年 12 月 29 日发布通知,规定受 ISO 80369-6 影响的旧产品必须在 2020 年 2 月底前停止销售。产品供应的最后期限考虑到公司便利而设定,因此麻醉医师别无选择,只能遵守。
应现场麻醉医师的强烈要求,出于安全原因,未引入可互换适配器。生产商和供应商行业协会 (MTJAPAN) 针对相关学术团体开展学术活动,答疑解惑。日本药品医疗器械综合机构 (Pharmaceuticals and Medical Devices Agency, PMDA) 提供了有关实施程序的具体细节。尽管采取了这些措施,但麻醉医师仍无法明确改用的必要性和可能性。
MHLW 关于日本改用 ISO 80369-6 的调查
日本相关机构执行了过渡,并在大约两年内完成改用。2024 年 6 月,MHLW 发布了一份关于从 2021 年开始向 ISO 80369-6 过渡的报告。4 该报告包含对麻醉医师和 MTJAPAN 进行的有限范围邮寄调查的结果。该调查主要针对日本麻醉医师协会 (JSA) 认证的机构,联系了 1447 家机构,收到了 329 份有效回复。
MHLW 调查的目的不是确定与患者相关的意外事件,而是调查与产品相关的问题;因此,麻醉医师处理的不良事件有可能被少报。
MHLW 调查结果和问题
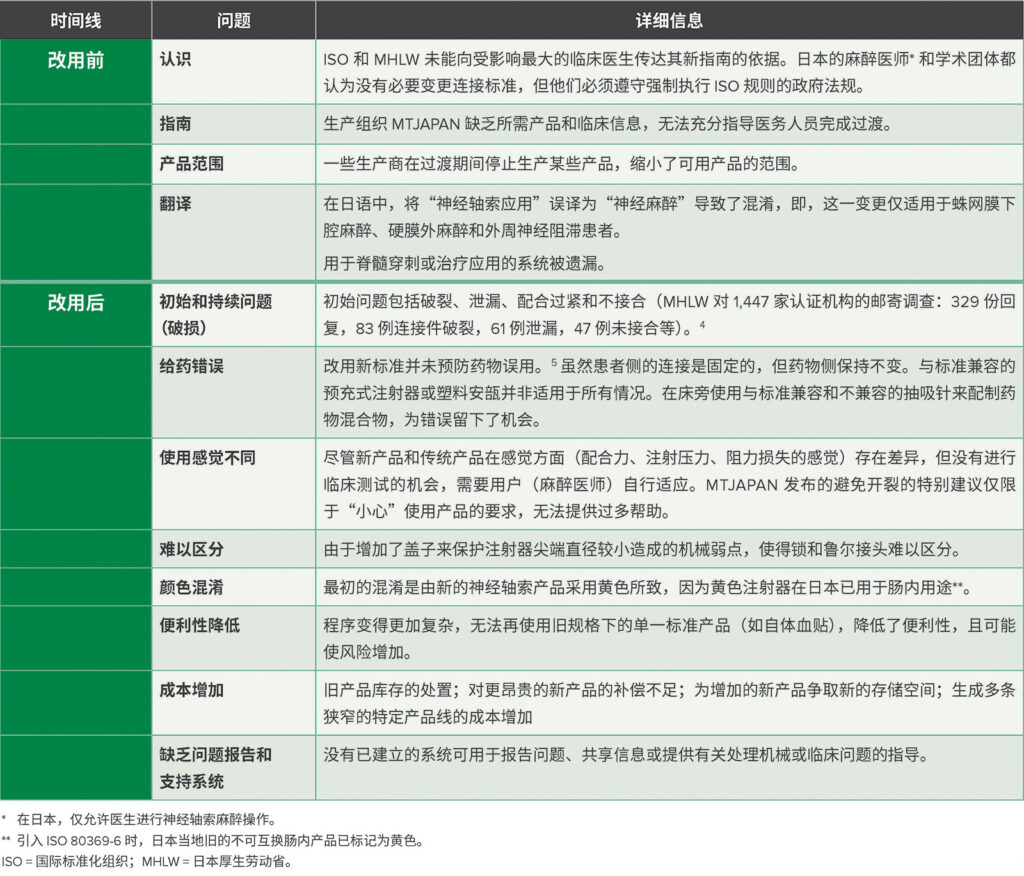
主要调查结果总结见表 2。我们对最初出现的问题数量感到震惊。
表 2:ISO 80369-6 变更过程中遇到的问题。
改用前咨询不足使临床医生处于不利地位,他们没有准备好应对这些变化。报告了多例患者照护过程中的破损和泄漏事件。得益于麻醉医师的快速应变能力,没有患者受到伤害。
带有连接件和预充式注射器的连接件套件并非广泛可用,因此,药物误用一直是令人担忧的一大问题。5 只有麻醉医师在工作中时刻保持严谨认真才能避免因药物连接不正确导致的错误。6
由于注射器和连接件不完全可用,新旧连接件并排放置,未彻底改用导致床旁混淆。导致其他不必要混淆的原因包括翻译不佳、连接件颜色重叠、产品可用性不足和资源浪费。最重要的是,在改用之前或之后,临床医生均没有可用于传达或报告问题的流程。
提出了以下几个问题:
1.临床参与不足
ISO 80369-6 标准的制定过程以及日本政府和生产商在国内的实施过程均缺乏实用临床信息。
ISO 80369 标准制定后,日本政府机构很少就是否需实施或适应国内临床情况展开讨论。
2.不平衡的观点(临床医生、生产商和监管机构)
生产商认为,生产符合标准但难以使用(尤其是对于信息不足的用户)的接头是可以接受且不可避免的。如果临床医生知悉这一点,他们会拒绝使用对患者安全造成风险的产品。
在未进行临床试验的情况下过渡至较小直径,导致与液体流量变化以及推力和旋转力增加相关的使用混淆。问题包括使用困难和连接件卡扣断裂。这迫使临床医生在现场工作时处理各类问题,如超强度接头和破裂连接件漏液。
3.缺乏临床可行性试验
在国内实施之前,有必要对不同产品(不同公司的产品)进行临床可行性研究,以避免患者受到伤害和对医生追责。然而,由于监管机构和生产商认为在全面引入之前进行临床可行性试验将违反竞争法,该观点被明确否定。日本在实施过程中遇到的大多数问题本可以通过适当的信息和准备来避免。令人遗憾的是,临床医生实际上被排除在讨论之外,他们唯一的选择就是接受行政管理决定。
4.缺乏透明度
监管机构错误地认为,新推出的产品已经符合新的权威性 ISO 标准,因此没有必要进行临床可行性试验。生产商认为没有必要告知临床医生新产品组合方式的“微小”变化。临床医生不了解日本的这一情况,也没有相关机构可帮助其解决这些问题。
ISO 的共识建立流程不包含该小组以外的人员,但遵守所制定的标准却是强制性的,并由日本当地行政机构大力推广。目前,需要遵循这些标准的用户(临床医生)只有在购买 ISO 官方出版物后才能获悉这些标准。
这一流程有待改进,它不仅阻碍了信息的及时传播,且技术性过强,普通医务人员无法理解。临床医生未意识到新标准导致产品出现巨大变化,因此经历了,诸如液体泄漏和由于超强度接头导致的连接破裂,这类可怕的临床后果。他们不得不在患者接受手术期间处理这些问题。
临床医生在国内实施 ISO 标准中的作用
为确保标准符合当地医疗照护、可用性和患者安全方面的要求,标准落地面临挑战。这些挑战包括考虑产品可用性、现有标准的功能变化、教育水平和专业责任范围。
在引入之前由临床医生进行可行性研究对于保护患者和验证标准在特定国家背景下的有效性至关重要,但却以违反竞争法为借口被拒绝。ISO标准的有效整合,需要在生产商效率与临床医生的全面参与以及迅速响应的国内采用流程之间取得平衡。从临床医生的角度出发,在实施之前缺乏临床可用性试验着实令人遗憾。
ISO 80369-3(肠内应用连接件)也遭遇了类似的问题。儿科医生遇到了实践问题,例如,由于新标准的直径要小得多,无法给予混合饮食或吸出胃内容物。这项于 2019 年开始、原定于 2021 年完成的改用被推迟。MHLW 在 2000 年推出了自己的不可换用连接(MHLW 第 888 号),该连接受到好评,但却被迫改为 ISO 80369-3。日本在 2022 年 5 月被迫允许新旧标准并存。7 混用情况一直持续至今。
令人难以置信的是,在 ISO 标准制定过程中,这样一个基本错误没有被注意到。日本于 2000 年推出了自己的不可换用肠内连接标准,令人遗憾的是,已得到验证的日本标准并未被 ISO 采用。
总结
ISO 发布了一系列 ISO 80369 标准,限制将注射器、针头和其他小直径部件之间的连接仅用于其预期用途。日本行政当局于 2018 年开始在全国范围内引入 ISO 80369-6(神经轴索应用连接件),作为实施新标准的一部分。据我们所知,这是全球范围内首例国家层面的改用。
这一决定在未充分咨询临床医生或专业麻醉组织的情况下做出。如果新产品符合新的 ISO 标准,即可在日本获得批准,但在未进行任何可行性试验的情况下引入临床实践。该领域的麻醉医师缺乏足够信息,遭遇了许多意想不到的问题,如破损和泄漏。
在改用过程中,未报告涉及人员生命的灾难性事故,但却发生了不容忽视的严重事件。
临床医生和医学协会,如 JSA 和 APSF,应更多地参与进来,以提高 ISO、行业和国内监管机构对临床意见重要性的认识。日本政府和行业决定权过大的原因之一与日本医疗专业的极度碎片化有关,这加大了各方的合作难度。
在临床环境中,关注产品的使用方式以及产品本身的质量至关重要。首要任务是确保患者生命安全。麻醉医师应避免威胁患者安全的情况发生。我们应该更多地参与 ISO 批准的围手术期器械的决策过程。
Sachiko Omi, MD, PhD 是东京医科大学(日本东京)的麻醉学客座教授。
Akito Ohmura, MD, PhD 是日本帝京大学医学院(日本东京)的名誉教授,也是 ISO TC 121 SC-3 主席。
Katsuyuki Miyasaka, MD, PhD 是圣路加国际大学(日本东京)的名誉教授。
作者没有利益冲突。
参考文献
- Examples of Medical Device Misconnections. https://www.fda.gov/medical-devices/medical-device-connectors/examples-medical-device-misconnections. Accessed July 30, 2024.
- ISO 80369-6:2016 Small bore connectors for liquids and gases in healthcare applications, Part 6: Connectors for neuraxial applications, published (Edition 1, 2016). https://www.iso.org/standard/50734.html. Accessed July 30, 2024.
- Article 2.4 of the TBT Agreement: Agreement on technical barriers to trade, technical regulations and dtandards, Article 2: Preparation, adoption and application of technical regulations by central government bodies, 1995. https://www.wto.org/english/docs_e/legal_e/17-tbt_e.htm. Accessed July 30, 2024
- Miyajima A. Pharmaceuticals and medical devices regulatory science policy research project: research on post-market safety measures for the safer and more effective use of new types of medical devices, etc. FY 2023 Summary and Joint Research Report (21KC2007). 2023 (In Japanese)
- Lefebvre PA, Meyer P, Lindsey A, et al. Unraveling a recurrent wrong drug-wrong route error— tranexamic acid in place of bupivacaine: a multistakeholder approach to addressing this important patient safety issue. APSF Newsletter. 2024;39:37,39–41. https://www.apsf.org/article/unraveling-a-recurrent-wrong-drug-wrong-route-error-tranexamic-acid-in-place-of-bupivacaine/. Accessed July 30, 2024.
- Institute for Safe Medication Practices (ISMP). Implement strategies to prevent persistent medication errors and hazards. ISMP Medication Safety Alert! Acute Care. 2023;28 (6):1–4. https://psnet.ahrq.gov/issue/implement-strategies-prevent-persistent-medication-errors-and-hazards Accessed July 30 2024.
- The distribution of new standard products (ISO80369-3) has been phased in starting from December 2019. https://www.pmda.go.jp/files/000246586.pdf. Accessed July 30 2024.


 Issue PDF
Issue PDF